Prawo Avogadro
- 2770
- 260
- Filip Augustyn
Jakie jest prawo Avogadro?
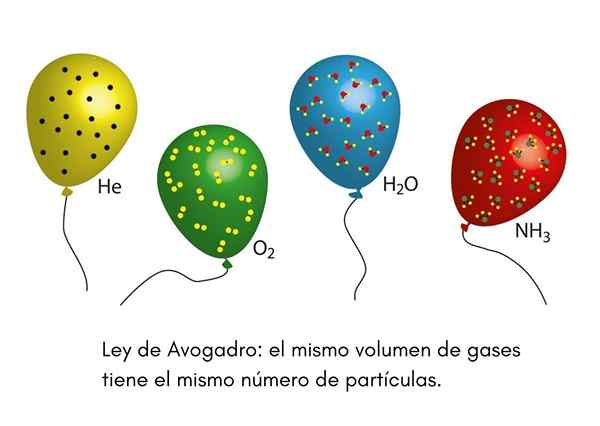
Prawo Avogadro, Nazywana także zasadą Avogadro, jest to prawo, które dotyczy gazów idealnych i zostało ogłoszone przez dziewiętnastego naukowca o nazwie Amadeo Avogadro. To prawo określa, że dwie równe objętości różnych gazów, które znajdują się w tych samych warunkach temperatury i ciśnienia, będą zawierać taką samą liczbę cząstek gazowych.
Oznacza to, że jeśli mamy dwa balony, jeden pełny z helem, a drugi z tlenem, a oba balony mają tę samą objętość, tę samą ciśnienie i tę samą temperaturę, wówczas będzie taka sama liczba gazowych atomów helu w pierwszym globe, że cząsteczki tlenu w drugim.
Formuła prawa Avogadro
Innym sposobem na określenie prawa Avogadro jest stwierdzenie, że jeśli utrzymanie stałego ciśnienia i temperatury będą utrzymywane, objętość gazu będzie proporcjonalna do liczby moli. Jest to reprezentowane w sposób matematyczny jako:
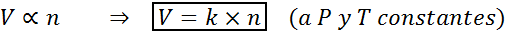
Ten wzór można zmienić na v/n = k, to znaczy, że związek między objętością a liczbą moli pozostaje stały, gdy p i t są stałe.
Tak więc, jeśli wprowadzimy lub usuniemy określoną ilość gazu ze stałej p i t, objętość zmieni się, a stan początkowy i końcowy będzie powiązany za pomocą następującego równania:
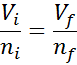
Warunki, w których zaspokajane jest prawo Avogadro
To prawo dotyczy dokładnie idealnych gazów. Są to gazy utworzone przez określone cząstki (które nie zajmują objętości w przestrzeni), które w żaden sposób nie oddziałują ze sobą.
Może ci służyć: biodiesel: historia, właściwości, typy, zalety, wadyJak sama nazwa wskazuje, ten rodzaj gazy nie istnieje w rzeczywistości, ale w naszej wyobraźni. Są uproszczonym „pomysłem” tego, co naszym zdaniem jest gazem. Istnieją jednak pewne warunki, w których prawdziwy gaz, taki jak powietrze, zachowuje się idealnie: przy bardzo niskich ciśnieniach i w bardzo wysokich temperaturach.
Niskie ciśnienia powodują, że objętość zajmowana przez cząstki gazu jest znikome w porównaniu z wielkością pojemnika, podczas gdy wysokie temperatury sprawiają, że cząsteczki poruszają się tak szybko, że nie mają czasu na interakcję, gdy krzyżują się ze sobą.
W tych warunkach większość gazów spełnia prawo Avogadro z dobrą dokładnością.
Znaczenie prawa Avogadro
Jednym z najważniejszych wkładów prawa Avogadro było to, że pozwoliło ono wykazać istnienie podstawowych gazów utworzonych przez więcej niż jeden atom2 lub h2. Przyczyniło się to do postępu teorii atomowej.
Ponadto prawo Avogadro uzupełnia prawa Boyle, Charlesa i Gay-Lussaca i łącząc je z tymi trzema prawami, prawo Avogadro zezwala na prawo gazów idealnych, jedno z najważniejszych przepisów chemii.
Z drugiej strony prawo Avogadro pozwala również na ustalenie zależności między masami cząsteczkowymi różnych gazów, ponieważ sugeruje, że masa równych objętości różnych gazów mierzonych w tej samej temperaturze i ciśnieniu jest proporcjonalna do masy każdej cząstki każdej gazu w przypadku gazu gazu.
Może ci służyć: azotan sodu (nano3): struktura, właściwości, zastosowania, ryzykoZatem przy pojedynczych próbkach żalu dwóch gazów, które zajmują objętości równe tej samej temperaturze i ciśnieniu, można uzyskać związek między jego masami molowymi.
Przykłady prawa Avogadro w życiu codziennym
Balony imprezowe
Widzieliśmy kiedykolwiek klauna na imprezie dziecięcej zawyżającej balony helu, aby rozpowszechniać je między dzieci. Te balony są w przybliżeniu w tej samej temperaturze. Jeśli dwa imprezy balony są wypełnione pod tym samym ciśnieniem i oba mają ten sam rozmiar, prawo Avogadro zapewnia, że oba balony będą miały taką samą liczbę moli helowych.
Z drugiej strony, jeśli jedno z balonów jest większe niż drugi, będzie miał większą objętość i, zgodnie z prawem Avogadro, będzie miała w środku większą ilość cząstek helowych.
Opony samochodu
Niezależnie od tego, który gaz jest wypełniony, opony po przeciwnych stronach samochodu są zawsze wypełnione do tego samego końcowego ciśnienia około 32 psi.
Ponadto zawsze upewniamy się, że oba gumki są takie same, więc będą miały tę samą głośność. Zatem, zgodnie z zasadą Avogadro, możemy powiedzieć, że oba opony będą zawierać tę samą liczbę cząstek gazowych.
Strzykawka pełna powietrza
Załóżmy, że mamy otwartą strzykawkę i pełne 50 cm3 powietrza. Jak to jest otwarte, wnętrze strzykawki i zewnętrzne (otoczenie) są w tej samej temperaturze i ciśnieniu.
Załóżmy teraz, że naciskamy tłok strzykawki i przesuwamy go do odczytu 10 cm3. Gdy strzykawka jest odkrywana, powietrze ucieka przez końcówkę w miarę poruszania się tłoka, więc liczba cząstek powietrza wewnątrz strzykawki zmniejsza się wraz z objętością.
Może ci służyć: ulatnianie sięPonieważ ani ciśnienie, ani temperatura zmieniają się, prawo Avogadro można zastosować, aby powiązać końcową objętość z ilością cząstek powietrza, które pozostają w strzykawce. Ten związek to:
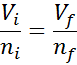
Zatrzymując to równanie, rozumiemy:
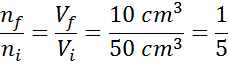
Wynik ten oznacza, że jeśli zmniejszymy objętość wewnątrz strzykawki do piątej, utrzymując stałą p i t, wówczas liczba moli lub cząstek obecnych na końcu procesu będzie również piątą częścią tego, co pierwotnie miało.


