Charakterystyka leucyny, struktura, funkcje, biosynteza
- 4459
- 1259
- Filip Augustyn
Leucyna Jest to jeden z 22 aminokwasów, które stanowią białka żywych organizmów. Należy do jednego z 9 niezbędnych aminokwasów, które nie są syntetyzowane przez organizm i muszą być spożywane z żywnością spożywaną w diecie.
Leucina została po raz pierwszy opisana w 1818 roku przez francuskiego farmaceuty i chemika. L. Proust, który nazwał to „podtlenkiem”. Później Erlenmeyer i Kunlin, przygotowali go z kwasu α-benzoilamido-β-izopropilacrylowego, którego wzorem cząsteczkowym jest C6H13NO2NO2.
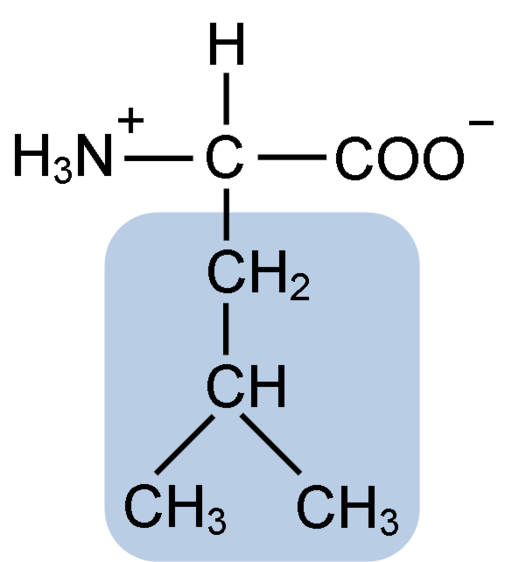
 Struktura chemiczna aminokwasu leucyny (fuene: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura chemiczna aminokwasu leucyny (fuene: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Leucyna była kluczowa podczas odkrycia poczucia translacji białka, ponieważ jej struktura hydrofobowa pozwoliła biochemikowi Howardowi dentzis na radioaktywne oznaczenie wodoru węgla 3 i obserwowanie znaczenia, w którym aminokwasy są włączone do peptydu syntezy hemoglobiny.
Białka znane jako „zamek” lub „zamknięcia” leuciny są, wraz z „palcami cynkowymi”, najważniejszymi czynnikami transkrypcyjnymi organizmów eukariotycznych. Zamki leucyny charakteryzują się ich hydrofobowymi interakcjami z DNA.
Zasadniczo białka bogate w leucynę lub składane przez rozgałęzione aminokwasy nie są metabolizowane w wątrobie, zamiast tego przechodzą bezpośrednio do mięśni, w których są one szybko wykorzystywane do syntezy białek i uzyskiwania energii energii.
Leucyna jest aminokwasem rozgałęzionego łańcucha niezbędnego do biosyntezy białek i aminokwasów mleka, które są syntetyzowane w gruczołach piersiowych. Duże ilości tego wolnego aminokwasu w mleku matki można znaleźć.
Spośród wszystkich aminokwasów, które tworzą białka, leucyna i arginina są najliczniejsze i oba zostały wykryte w białkach wszystkich królestw, które tworzą drzewo życia.
[TOC]
Charakterystyka
Leucyna jest znana jako niezbędny aminokwas rozgałęzionego łańcucha, ma typową strukturę z innymi aminokwasami. Wyróżnia się jednak, ponieważ jego łańcuch boczny lub grupa R ma dwa węgle, a ostatni jest powiązany z atomem wodoru i dwiema grupami metylowymi.
Należy do grupy aminokwasów polarnych bez obciążenia, podstawniki lub grupy R tych aminokwasów są natury hydrofobowe. Te aminokwasy są głównymi odpowiedzialnymi za interakcje hydrofobowe wewnątrz proteicowego i mają tendencję do stabilizacji struktury białek.
Wszystkie aminokwasy o centralnym węgle, które jest chiralne (węgiel α), to znaczy ma cztery różne podstawy zjednoczeni, można je znaleźć na dwa różne sposoby natury; Zatem istnieją D- i L-leucina, te ostatnie typowe w strukturach białkowych.
Obie formy każdego aminokwasu mają różne właściwości, uczestniczą w różnych drogach metabolicznych, a nawet mogą modyfikować charakterystykę struktur, których są częścią.
Na przykład leucyna w L-leucina ma nieco gorzki smak, podczas gdy w postaci D-leucyny jest bardzo słodka.
Forma dowolnego aminokwasu jest łatwiejsza do metabolizowania przez ciało ssaków. L-leucina jest łatwo zdegradowana i wykorzystywana do budowy i ochrony białek.
Struktura
Leucyna składa się z 6 atomów węgla. Centralny węgiel, powszechny we wszystkich aminokwasach, jest powiązany z grupą karboksylową (COOH), grupą aminową (NH2), atomem wodoru (H) i łańcuchem bocznym lub grupy R -R złożonej z 4 atomów węgla.
Może ci służyć: MesothelioAtomy węgla w aminokwasach można zidentyfikować za pomocą greckich liter. Numerowanie rozpoczyna się od węgla kwasu karboksylowego (COOH), podczas gdy adnotacja z greckim alfabetem zaczyna się od centralnego węgla.
Leucyna ma jako grupę podstawnikową w łańcuchu R do grupy izobutylowej lub 2-metylopropilowej, która jest wytwarzana przez utratę atomu wodoru, z tworzeniem rodnika alkilowego; Grupy te pojawiają się jako konsekwencje w strukturze aminokwasowej.
Funkcje
Leucyna jest aminokwasem, który może służyć jako ketogeniczny prekursor innych związków zaangażowanych w cykl kwasu cytrynowego. Ten aminokwas stanowi ważne źródło syntezy acetylo-CoA lub acetoacetylo-CoA, które są częścią dróg formacji ciał ketonowych w komórkach wątroby.
Wiadomo, że leucyna jest niezbędna na trasach sygnalizacji insuliny, która uczestniczy w początku syntezy białka i unika utraty białka z powodu degradacji.
Zwykle wewnętrzne struktury białek składają się z hydrofobowych aminokwasów, takich jak leucyna, walina, izoleucyna i metoda. Takie struktury są zwykle konserwowane dla wspólnych enzymów wśród żywych organizmów, jak w przypadku cytochromu C.
Leucyna może aktywować drogi metaboliczne w komórkach gruczołu sutkowego w celu stymulowania syntezy laktozy, lipidów i białek, które wypełniają funkcje, takie jak cząsteczki sygnalizacyjne w regulacji homeostazy energetycznej młodych ssaków.
Domeny bogate w leucynę są istotną częścią specyficznych białek wiążących DNA, które są na ogół średnice strukturalne w super zapisany sposób i które są znane jako „białka na zamek błyskawiczne”.
Białka te mają jako charakterystyczną charakterystykę regularnego wzoru powtarzających się leucyn wraz z innymi hydrofobowymi aminokwasami, które są odpowiedzialne za regulację związków czynników transkrypcyjnych do DNA i między różnymi czynnikami transkrypcyjnymi.
Białka suwowe leucyny mogą tworzyć homo-heterodimery, które na nie pozwalają.
Biosynteza
Wszystkie rozgałęzione aminokwasy łańcuchowe, w tym leucyna, są głównie syntetyzowane w roślinach i bakteriach. W roślinach kwitnących występuje znaczny wzrost produkcji leucyny, ponieważ jest to ważny prekursor dla wszystkich związków odpowiedzialnych za aromat kwiatów i owoców.
Jednym z czynników przypisywanych wielkiej obfitości leucyny w różnych peptydach bakteryjnych jest to, że 6 różnych kodonów kodu genetycznego kodowania leucyny (UUA-UUG-UUG-CUC-CUA-CUG), to samo dotyczy również argininy.
Leucyna jest syntetyzowana w bakteriach z pięciostopowej trasy, która wykorzystuje jako punkt wyjścia Ketacyd związany z valiną.
Proces ten jest regulowany z alosteratycznie, tak że w przypadku nadmiaru leucyny wewnątrz komórek, hamuje enzymy, które uczestniczą w trasie i zatrzymuje syntezę.
Może ci służyć: indeks Simpson: formuła, interpretacja i przykładTrasa biosintetyczna
Biosynteza leucyny w bakteriach rozpoczyna się od konwersji pochodnej ketacydów waliny, 3-metylo-2-oksobutanoat w (2s) -2-izopropilmalanu, dzięki działaniu enzymu 2-izopropilmalto, który stosuje acetylo-alizyt. -Coa i woda w tym celu.
(2S) -2-izopropilmalaat traci cząsteczkę wody i jest przekształcany w 2-izopropilmalenian przez 3-izopropylomalanową dehydratazę. Następnie ten sam enzym dodaje kolejną cząsteczkę wody i przekształca 2-izopropilmaleo w (2R-3S) -3-izopropilm.
Ten ostatni związek jest poddawany reakcji oksydorredukcyjnej, która zasługuje na uczestnictwo cząsteczki NAD+, która wytwarza (2S) -2-izopropil-3-oksosuksykinę, która jest możliwa z udziałem enzymu 3-izopropilmalato delebrogenazy.
(2S) -2-Osopropylo-3-oksosuccynacja traci atom węgla w postaci CO2 spontanicznie, generując 4-metylo-2-oksopentanoesan, który przez działanie transaminazy rozgałęzionych aminokwasów (leucyny transaminazy, konkretnie) A przy jednoczesnym wyzwoleniu L-glutaminianu i 2-oksoglutaranu produkuje L-Leucina.
Degradacja
Główną rolą leucyny jest działanie jako sygnalizacja, która mówi komórce, że istnieje wystarczająca ilość aminokwasów i energii, aby rozpocząć syntezę białek mięśniowych.
Degradacja rozgałęzionych aminokwasów łańcuchowych, gdy leucyna zaczyna się od transaminacji. To i dwa kolejne etapy enzymatyczne są katalizowane przez trzy enzymy w przypadku leucyny, izoleucyny i waliny.
Transaminacja trzech aminokwasów wytwarza pochodne α-sotoacidowe z nich, które podlegają oksydacyjnej dekarboksylacji do wytworzenia tioés acylo-coa, które są α, β-dishydrogene.
Podczas katabolizmu leucyny odpowiadające odkrycie acylo-CoA, β-insycytowane β-insatura (HMG-COA), który jest pośrednikiem w biosyntezy cholesterolu i innych izoprenoidach.
Kataboliczna trasa leuciny
Od tworzenia wuja acyl-CoA α, β-insycytowane, które pochodzi od leucyny katabolicznej drogi tego aminokwasu i waliny i izoleucyny znacznie rozbieżą się.
Leucina α, β-coa UCION, β jest przetwarzana w dół przez trzy różne enzymy znane jako (1) 3-metylokrotonylo-CoA karboksylaza, (2) 3-metyloglutakonilu-CoA hydratasa i (3) 3-hydroksi-3-mitylometyllutarililililillu -Coa Liasa.
W bakteriach enzymy te są odpowiedzialne za konwersję 3-metylokrotonylo-CoA (pochodnej leucyny) w 3-metyloglutakonilu-CoA, odpowiednio w 3-hydroksy-3-metyloglutarilil-CoA.
Leucyna dostępna we krwi jest wykorzystywana do syntezy białek mięśni/miofibrylarnych (MPS). Działa to jako czynnik aktywujący ten proces. Także oddziaływać bezpośrednio z insuliną, wpływając na dostawę
Żywność bogata w leucynę
Spożywanie bogatych białek aminokwasowych jest niezbędne dla fizjologii komórkowej żywych organizmów, a leucyna nie jest wyjątkiem wśród niezbędnych aminokwasów.
Białka uzyskane z surowicy mleczarskiej są uważane za najbogatsze w resztach L-leuciny. Jednak wszystkie pokarmy o wysokiej zawartości białka, takie jak ryby, kurczak, jajko i czerwone mięso, zapewniają duże ilości leucyny dla organizmu.
Może ci służyć: reprodukcja wirusów: fazy i cechyKukurydza w ziarnach jest słaba w aminokwasach lizyny i tryptofanu, ma bardzo sztywne struktury trzeciorzędowe do trawienia i ma niewielką wartość z punktu widzenia odżywczego, jednak ma wysoki poziom leucyny i izoleucyny.
Owoce roślin strączkowych są bogate w prawie wszystkie niezbędne aminokwasy: lizyna, tronina, izoleucyna, leucyna, fenyloalanina i walina, ale mają niewielką zawartość metody i cysteiny.
Leucyna jest ekstrahowana, oczyszczana i koncentrowana w tabletkach jako suplementy ds. Żywności dla sportowców o wysokich konkurencjach i jest sprzedawana jako lek. Główne źródło izolacji tego aminokwasu odpowiada mąki sojowej.
Istnieje suplement żywieniowy stosowany przez sportowców do regeneracji mięśni znanych jako BCAA (angielski ”Rozgałęziony aminokwas łańcuchowy "). Zapewnia to wysokie stężenia rozgałęzionych aminokwasów: leucina, walena i izoleucyny.
Korzyści z Twojego spożycia
Żywność bogata w leucynę pomaga kontrolować otyłość i inne choroby metaboliczne. Wielu dietetyków wskazuje, że żywność bogata w suplementy ds. Leucyny i żywieniowe na podstawie tego aminokwasu przyczyniają się do regulacji apetytu i lęku u dorosłych.
Wszystkie białka bogate w leucynę stymulują syntezę białek mięśniowych; Wykazano, że wzrost odsetka połkniętej leucyny w odniesieniu do innych niezbędnych aminokwasów może odwrócić tłumienie syntezy białek w muskulaturze pacjentów starszych.
Nawet osoby z poważnymi zaburzeniami plamki, które są sparaliżowane, mogą zatrzymać utratę masy i siły mięśni z prawidłową suplementacją doustną leucyną, oprócz zastosowania ćwiczeń ogólnoustrojowych odporności na mięśnie.
Leucyna, valina i izoleucyna są niezbędnymi składnikami masy, które tworzą mięsień szkieletowy zwierząt kręgowców, więc ich obecność jest niezbędna do syntezy nowych białek lub naprawy wcześniejszych.
Zaburzenia niedoboru
Niedobory lub wady rozwoju kompleksu dehydrogenazy α-Z-Z-Stoat, który jest odpowiedzialny za metabolizowanie leucyny, waliny i izoleucyny u ludzi, mogą powodować poważne zaburzenia psychiczne.
Ponadto istnieje stan patologiczny związany z metabolizmem tych rozgałęzionych aminokwasów łańcuchowych zwanych „chorobą moczu z zapachem syropu arce”.
Do tej pory nie wykazano istnienia niepożądanego wpływu na nadmierne spożycie leucyny. Jednak zaleca się maksymalną dawkę 550 mg/kg dziennie, ponieważ nie przeprowadzono długoterminowych badań związanych z nadmierną ekspozycją na tkankę na wspomniane aminokwasowe.
Bibliografia
- Álava, m. D. C., Camacho, m. I., & Delgadillo, J. (2012). Zdrowie mięśni i zapobieganie sarkopenii: wpływ białka, leucyny i ß-hydroksy-ß-metylobutiratów. Magazyn metabolizmu kości i minerałów, 10(2), 98-102.
- Fenheme lub. R. (1993). Chemia gastronomiczna (NIE. 664: 543). Odwołanie.
- Massey, L. K., Sokatch, J. R., & Conrad, r. S. (1976). Rozgałęziony łańcuch aminokwasowy katabolizm u bakterii. Recenzje bakteriologiczne, 40(1), 42.
- Mathews, c. K., & Ahern, K. G. (2002). Biochemia. Edukacja Pearsona.
- Zwykłe, a. (1999). Suplementacja leucyny i intensywne szkolenie. Medycyna sportowa, 27(6), 347-358.
- Munro, godz. N. (Ed.). (2012). Metabolizm białka ssaków (Tom. 4). Elsevier
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.

