Hydronio jon
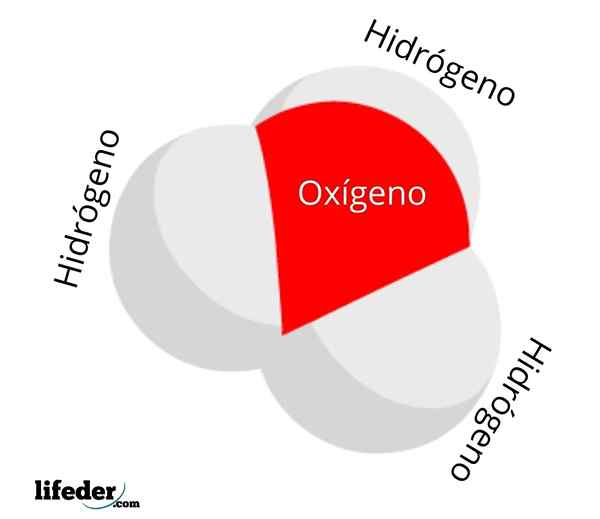
- 933
- 50
- Bertrand Zawadzki
Co to jest jon hydroniowy?
On Hydronio jon Jest to rodzaj dodatniego obciążenia, które wynika z protonowania cząsteczki wody, a której wzór chemiczny wynosi h3ALBO+. Składa się z najprostszych z oksonianów: jonów, w których tlen ma dodatnie obciążenie formalne i ma trzy wiązania kowalencyjne.
H3ALBO+ Jest to jeden z najprostszych, ale ciekawych kationów, które istnieją. W wodzie w normalnych warunkach ma stężenie 1,10-7 M, Produkt równowagi samookreślenia. Jednak jego stężenie wzrasta wykładniczo, gdy jest silny3ALBO+ Rozpuszczają się w wodzie, zakwaszając ją.
 Cząsteczka jonów hydronowych
Cząsteczka jonów hydronowych Stężenie lub aktywność H3ALBO+ W wodzie służy do pomiaru kwasowości roztworów wodnych: pH. Im więcej jonów H3ALBO+ Siano, mniej pozytywne będzie to pH, a więcej kwas. Z drugiej strony ta kwasowość leży w jonie wodoru, h+, który jest często mylony z jonem h3ALBO+.
 Wzór jonowy lub hydronio
Wzór jonowy lub hydronio H+ a jego niesamowita zdolność do przenoszenia między mostami wodoru cząsteczek wody pozwala H3ALBO+ kojarzyć w bardziej złożonych formacjach kationów; takie jak kation eigen, h9ALBO4+, i kation Zundela, h5ALBO2+, i wiele innych.
Struktura jonów hydronowych
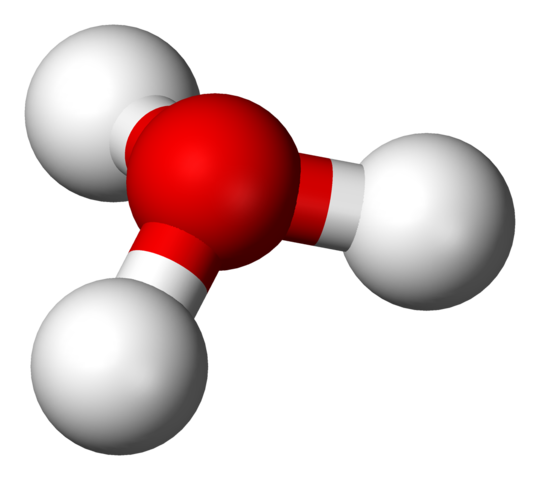 Struktura H3O+ z modelem sfer i słupków
Struktura H3O+ z modelem sfer i słupków Na pierwszym obrazie można było zobaczyć formułę strukturalną jonu hydrium. Teraz widzimy jego reprezentację za pomocą modelu sfery i słupków. W obu podkreślenia geometria piramidy trygonalnej, której kąty łącza (O-H) wynosi 113º; Trochę odwrócone od 119º dla tetrahedronu.
Chociaż tlen ma dodatnie obciążenie częściowe, nie oznacza to, że region ujemny dotyczy atomów wodoru. Przeciwnie. Tlen w godz3ALBO+ Jest to jeszcze bardziej elektroujemny produkt jego niedoboru elektronicznego; Tak więc cała ujemna gęstość wizualizowana na elektrostatycznej mapie:
Może ci służyć: siarczan potasu (K2SO4): struktura, właściwości, zastosowania, synteza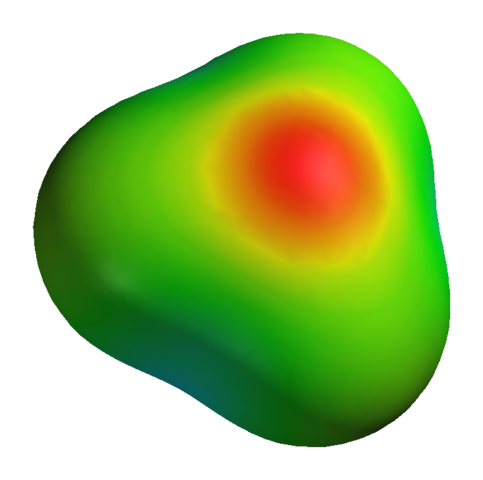 Mapa potencjału elektrostatycznego dla H3O+
Mapa potencjału elektrostatycznego dla H3O+ Nie wspominając o tym, że tlen ma kilka wolnych elektronów, co wzmacnia jeszcze większą gęstość ujemną.
Konsekwencją wszystkich powyższych jest to, że H hydrogeny3ALBO+ Tracą gęstość elektroniczną, ponieważ tlen przyciąga ją do siebie. Dlatego h3ALBO+ Możesz ustanowić bardzo silne źródła wodoru z sąsiednią cząsteczką wody: H2ALBO+-H-OH2.
Ta interakcja jest kluczem za niesamowitą mobilnością jonową H+ i dlaczego h3ALBO+ Jest w stanie jednocześnie kojarzyć się z wieloma cząsteczkami wody.
Kwasowość
Jon hydronio jest bardzo silnym kwasem. W rzeczywistości jest to najsilniejszy kwas, który może istnieć w roztworze wodnym. Ponieważ? Ponieważ każdy inny kwas silniejszy od niego będzie protonować cząsteczkę wody, aby powstać h3ALBO+:
Ha + h2O → a- + H3ALBO+
H3ALBO+ Jest w stanie pozostać stabilny, gdy w środowisku nie ma innych baz, które są silniejsze niż woda. Każdy kwas przestanie się z tym sklasyfikować jako silny kwas. Tymczasem, jeśli kwas jest słabszy niż H3ALBO+, Wtedy część HA nie zostanie całkowicie oddzielona i porozmawiamy o słabym kwasie:
Ha + h2Lub ⇌ a- + H3ALBO+
Dlatego od h3ALBO+ Jest to najsilniejszy kwas, który istnieje w wodzie, kwasowość tego będzie zależeć od stężenia H3ALBO+. Jest to podstawa do zdefiniowania, w prostym kategoriach, kwasowości roztworu wodnego wyrażonego jako pH:
ph = -log [h3ALBO+]
H+ vs. H3ALBO+
Jon wodoru i hydronium to nie takie same. H+ Jest o wiele bardziej kwaśny niż h3ALBO+, Cóż, składa się z protonu nic więcej, który będzie szukał cząsteczki, która zyskała elektrony. Kiedy h+ Uzyskaj cząsteczkę wody3ALBO+:
Może ci służyć: tlenku miedzi (CUO)H+ + H2O → h3ALBO+
Dlatego H. H3ALBO+ może być reprezentowane jako h+(Ac), wskazując, że jest to h+ W wodnym pożywce.
Siła kwasu mierzy się w jego zdolności do przekazywania, zgodnie z definicją Brönsteda-Lowry, H jonów+. O ile to jest silniejsze, tym bardziej darowi się darowizny+, Bez h3ALBO+. Najsilniejsze kwasy, jakie kiedykolwiek zsyntetyzowane (supercydy) to te, w których h+ On jest „nagi”; to znaczy bez przeszkód, by skakać w kierunku cząsteczki, która będzie protonować.
Praktyka reprezentowania H3ALBO+ popiół+(AC) Jest tak powszechne, że wiele razy mówi się o obu, jakby były takie same, bez tego negatywnego wpływu na interpretację chemii rozwiązań.
Solvation
H3ALBO+ Może tworzyć bardzo silne mosty wodorowe z sąsiednią cząsteczką wody. Czyniąc to, mamy kation Zundel, H5ALBO2+:
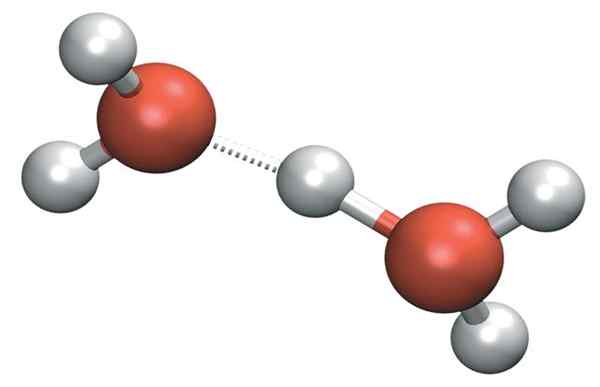 Kation Zundel
Kation Zundel Ale dodatnie obciążenie pozostaje nie tylko po jednej stronie kationu: można to przenieść do drugiej cząsteczki wody, takiej jak jon h+:
H2Oh-+Oh2 → H2ALBO+-H- Och2
Dlatego obciążenie dodatnie rozkłada się między oba atomy tlenu dla dwóch cząsteczek wody.
W przypadku kationu własnego, h9ALBO4+, h3ALBO+ tworzyć mosty wodorowe z trzema cząsteczkami wody, rozmieszczając między nimi dodatnie obciążenie dzięki „skokowi” H+. Te skoki są tak szybkie, że wyjaśniają wielką mobilność jonową H+ W wodzie, używając h3ALBO+ jako pojazd i cząsteczki wody jak autostrada.
H5ALBO2+ i H9ALBO4+ Nie są jedynymi kationowymi skojarzeniami, które H3ALBO+ może pochodzić z wody. Niektóre obliczenia dynamiki molekularnej pokazują istnienie klastra H3ALBO+(H2ALBO)20: 20 H molekułów2Lub interakcja z kationą H3ALBO+ i rozpowszechnianie między nimi obciążenia dodatnie.
Może ci służyć: neodym: struktura, właściwości, użyciaDlatego h3ALBO+ i H+ Budują ciekawy związek z cząsteczkami wody, poza kwasowością.
Ty wyjdź
Tak jak istnieją organiczne pokoje tlenowe, nie jest to wyjątek z tlenami pochodzącymi z protonacji wody. Jego ogólna formuła to [H3ALBO+] [X-], Gdzie x- Jest to każdy anion, który pochodzi z rozwiązania bardzo silnego kwasu.
Sole te czasami otrzymują nazwę „kwasów monohydratowych”, ponieważ wzór [H3ALBO+] [X-] lub h3ALBO+· X- Można go również zapisać jako hx · h2ALBO. Zatem mogą istnieć kwasy dihydratu, Hx · 2H2Lub, trihydraty, hx · 3H2Lub itd.
Na przykład HCl może krystalizować jako hcl · h2OH3ALBO+· Cl-. Mamy również inne sole hydronowe, takie jak H3ALBO+· Clo4- lub HCLO4· H2Lub i HBR · 4H2OH3ALBO+· Br-· 3H2ALBO.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Inorgán ChemistryICA. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Hydron. Źródło: w:.Wikipedia.org
- Avneet Kahlon i Stephen Lower. (15 sierpnia 2020). Jon hydronowy. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Helmestine, Anne Marie, pH.D. (25 sierpnia 2020). Definicja jonu hydronowego. Odzyskane z: Thoughtco.com
- Redaktorzy Enyclopaedia Britannica. (2020). Jon wodoru. Odzyskane z: Britannica.com

