Immunoglobulina M (IGM)
- 1083
- 223
- Eugenia Czapla
Co to jest immunoglobulina m?
Immunoglobulina m albo IgM Jest to przeciwciało wytwarzane przez komórki B lub limfocyty układu odpornościowego wielu zwierząt. Może być powiązany z błoną plazmatyczną tych komórek lub może być wydzielany w postaci kompleksu w kierunku krwioobiegu i limfy, więc aktywnie uczestniczy w procesach odporności humoralnej lub adaptacyjnej.
Podobnie jak inne immunoglobuliny (IgG, IgA, IgD i IgE), immunoglobulina M ma strukturę taką, że umożliwia ona dołączenie dowolnego rodzaju antygenu, w tym białka, glikoprotein, polisacharydy i inne karabiny, kwasy nukleinowe, lipidy, lipidy, lipidy, lipidy, lipidy, lipidy inni.
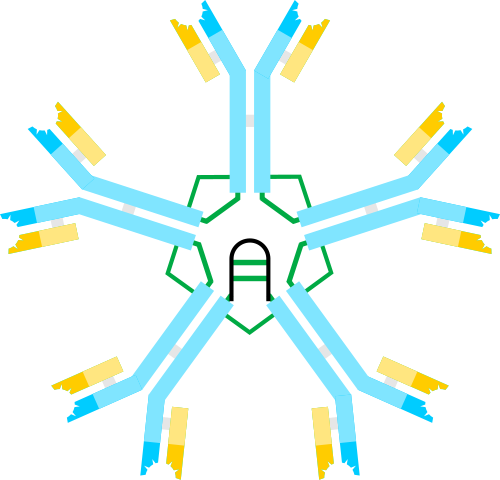
 Schemat immunoglobuliny, pentmer. Autor: Artur Jan Fijałkowski, Wikimedia Commons
Schemat immunoglobuliny, pentmer. Autor: Artur Jan Fijałkowski, Wikimedia Commons IGM jest jednym z pierwszych przeciwciał wytwarzanych podczas infekcji bakteryjnej i podczas rozwoju noworodków.
Był pierwszym, który oczyszczał się ze znaczącą jednorodnością, a ponieważ jest to przeciwciało reaktywne, to znaczy ma możliwość łączenia dwóch lub więcej antygenów jednocześnie, nawet jeśli mają one różne natury, jest to bardzo ważne dla walki z innymi Patologie.
Jako „naturalne przeciwciała”, to znaczy te, które występują bez umyślnej wcześniejszej immunizacji, te immunoglobuliny mogą nie tylko łączyć antygeny bakteryjne, ale także wirusom, pierwotniakom, pasożytach metazoar.
Struktura IGM
Podobnie jak opisane dla immunoglobuliny G, jednej z najliczniejszych przeciwciał w osoczu krwi i innych immunoglobulin, monomery immunoglobuliny M mają strukturę, którą można opisać jako „Y”, chociaż ten przeciwciał zwykle występuje w plazma jako pentamer.
Każde z 5 podjednostek tej penthamerycznej glikoproteiny powstaje przez cztery łańcuchy: dwa identyczne łańcuchy ciężkie „μ” 55 kDa i dwa identyczne łańcuchy światła 25 kDa, które, gdy są powiązane w rozpuszczalnej postaci pentamerycznej, waży około 970 kDa.
Może ci służyć: oddychanie skóry: charakterystyka i przykłady zwierzątLekkie łańcuchy łączą się tylko z częścią ciężkich łańcuchów dzięki tworzeniu mostów disiarczkowych między odpadami cysteinowymi.
Kiedy te cząsteczki są enzymatycznie hydrolizowane, reakcja ta powoduje dwa fragmenty, jeden z nich „homogeniczny”, znany jako region stały lub FC, a drugi znany jako region zmienny lub FAB2 (zwany również regionem hiperwarialnym), zdolnym do połączenia Antygen.
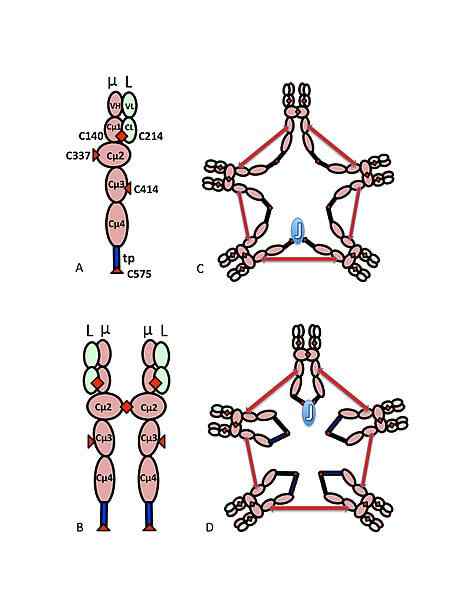 Schematyczny model IgM. Źródło: Marc Shulman, CC BY-SA 4.0, Via Wikimedia Commons
Schematyczny model IgM. Źródło: Marc Shulman, CC BY-SA 4.0, Via Wikimedia Commons Sekwencja aminokwasowa ciężkiego łańcucha immunoglobuliny M, zwłaszcza stałego regionu, jest tym, co określa jego tożsamość, a także definiuje sekcję innych izotypów przeciwciał, które zostały zdefiniowane u zwierząt, które razem tworzą nadrodzina immunoglobulin.
Trzeciorzędowa struktura ciężkich i lekkich łańcuchów tego przeciwciała składa się z β-spłaty arkuszy połączonych ze sobą poprzez powiązania o zmiennej długości, które mogą być stabilizowane przez mosty disiarczkowe.
W postaci pentamérica każdy monomer IgM oddziałuje z łańcuchem polipeptydowym zwanym łańcuchem JDA, co pozwala na tworzenie struktury utworzonej przez 5 monomerów.
Ponieważ każdy monomer ma zdolność do przyłączenia się do dwóch identycznych cząsteczek antygenowych, pentamer IgM może łączyć 10 antygenów jednocześnie.
Funkcje
Immunoglobulina M uczestniczy w początkowej odpowiedzi na antygeny bakteryjne, więc zwykle jest to pierwsze przeciwciało wydzielane przez aktywowane komórki B podczas odpowiedzi immunologicznej.
Ponieważ jego rozpuszczalna struktura jest w stanie dołączyć do dużej liczby cząsteczek antygenu, ma zdolność do dodawania lub aglutynowania cząstek antygenowych należących do komórek takich jak czerwone krwinki, bakterie, pierwotniak i inne.
Może ci służyć: Gap AnionTo przeciwciało jest bardzo ważne dla wczesnej neutralizacji toksyn bakteryjnych i jest również skuteczne w mediacji aktywności układu dopełniacza, promując szybką „opsonizację” cząstek antygenowych.
 Graficzna reprezentacja immunoglobuliny M powiązanej z epitopami antygenowymi bakterii inwazyjnych (źródło: SA1590 [CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Graficzna reprezentacja immunoglobuliny M powiązanej z epitopami antygenowymi bakterii inwazyjnych (źródło: SA1590 [CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Jego monomeryczny kształt jest ogólnie powiązany z błoną plazmatyczną limfocytów „Virgin” B, a także z immunoglobuliną D, i ustalono, że znaczna część repertuaru noworodka B komórek B odpowiada limfocytom z IGM w jej błonie.
Konieczne jest również podkreślenie faktu, że jest to pierwsza immunoglobulina wytwarzana przez „dziewicze” komórki B w płodach podczas ciąży, po pierwszych stymulacjach antygenowych.
Chociaż w niskim stężeniu stwierdzono immunoglobulinę M w wydzielania zwierząt ssaków, fakt, który sugeruje, że uczestniczy również w ochronie immunologicznej błon śluzowych ciała.
Wysokie wartości (znaczenie) IgM
Uważa się, że osoba ma wysokie wartości immunoglobuliny, gdy badania wykazują wartości powyżej normalnego zakresu.
Wysokie wartości mazmetycznej immunoglobuliny mogą wskazywać na niedawną ekspozycję na antygen, a także wczesny stadium wirusowego zapalenia wątroby i innych chorób patologicznych, takich jak:
- mononukleoza,
- reumatoidalne zapalenie stawów,
- Waldestrom makroglobulinemia,
- Zespół nerczyniczy (uszkodzenie nerek)
- Rozwój infekcji spowodowanych przez środki pasożytnicze
Innym powodem, dla którego wysokie wartości IgM można uzyskać w surowicy, jest istnienie zespołów „hiper IgM” (HIGM). Pacjenci z tym zespołem są bardziej podatni na cierpienie nawracających infekcji, a nawet różnych rodzajów raka, ponieważ wymaga drastycznego spadku poziomów IgG.
Może ci służyć: narządy analogowe: koncepcja, ewolucja, cechy i przykładyNiskie wartości (znaczenie)
Istnienie niektórych znaczących patologii, takich jak mnóstwo szpiku, niektóre rodzaje białaczki i niektóre dziedziczne choroby immunologiczne zostały skorelowane z niskim poziomem immunoglobuliny M w surowicy w surowicy.
Pacjenci z zespołem niedoboru powiązanego z chromosomem X Wiskott-Aldrich może mieć niski poziom IgM, jednak niewielki wzrost poziomów pozostałych czterech immunoglobulin może zrekompensować ten stan.
Niski poziom IgM może wskazywać na cięższe warunki, takie jak niedobór immunoglobuliny, który może mieć poważne implikacje zdrowotne, szczególnie podczas narażenia na nowe antygeny lub podczas niektórych chorób.
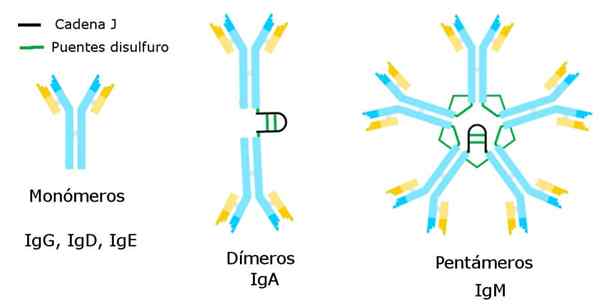 Rodzaje immunoglobulin. Źródło: Alejandro Porto, CC BY-SA 3.0, Via Wikimedia Commons
Rodzaje immunoglobulin. Źródło: Alejandro Porto, CC BY-SA 3.0, Via Wikimedia Commons Niedobory te mogą mieć wiele przyczyn, od błędów w systemach rozpoznawania antygenowego do defektów w produkcji przeciwciała przez limfocyty B.
Poziomy tak niskie jak 40 mg/dl zgłaszano u tych pacjentów z selektywnymi niedoborami IgM, które składają się z „rzadkiej” formy dysgammaglobulinemii.
Wartości normalne
Normalny zakres stężenia w osoczu immunoglobuliny M jest niezwykle zmienny i zależy od wielu rzeczy, od wieku. Według różnych grup wiekowych to przeciwciało jest w stężeniu:
- 26-122 mg/dl od 0 do 5 miesięcy
- 32-132 mg/dl od 5 do 9 miesięcy
- 40-143 mg/dl od 9 do 15 miesięcy
- 46-152 mg/dl między 15 a 24 miesiącem
- 37-184 mg/dl między 2 a 4 latami
- 27-224 mg/dl między 4 a 7 latami
- 35-251 mg/dl od 7 do 10 lat
- 41-255 mg/dl od 10 do 13 lat
- 45-244 mg/dl między 13 a 16 latami
- 49-201 mg/dl między 16 a 18 latami
- 37-286 mg/dl u dorosłych w ciągu 18 lat, chociaż niektóre teksty wskazują, że zakres wynosi od 45 do 150 mg/dl, od 45 do 250 mg/dl lub od 60 do 360 mg/dl
Ważne jest, aby wspomnieć, że te wartości stężenia IgM są mniej więcej 10 razy niższe niż w przypadku innych ważnych immunoglobulin, takich jak IgG, na przykład.
- « 18 najlepszych mitów Meksyku (bogowie i zwierzęta)
- 17 Problemy środowiskowe w bardzo poważnym Meksyku »

