Charakterystyka holoenzymu, funkcje i przykłady
- 3269
- 808
- Pani Waleria Marek
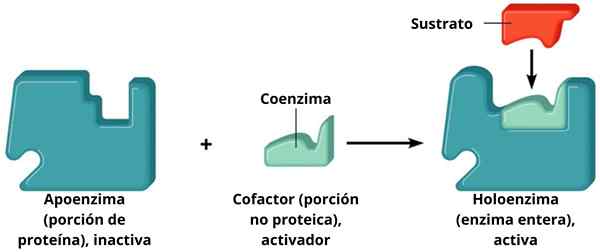
A Holoenzyme Jest to enzym utworzony przez część białkową zwaną apoenzymem w połączeniu z cząsteczką nie -białko zwaną kofaktorem. Ani zwolennik, ani kofaktor nie są aktywne, gdy są osobno; to znaczy, aby funkcjonować, należy je połączyć.
Zatem holoenzymy są połączonymi enzymami, a zatem są aktywne katalizatory. Enzymy są rodzajem biomolekuł, których funkcja zasadniczo zwiększa prędkość reakcji komórkowych. Niektóre enzymy potrzebują pomocy innych cząsteczek, zwanych kofaktorami.
 Obsługa + Cofactor = holoenzyme
Obsługa + Cofactor = holoenzyme Kofaktory uzupełniają się wzajemnie i tworzą aktywny holoenzym, który wykonuje kataliza. Te enzymy wymagające konkretnego kofaktora są znane jako enzymy sprzężone. Mają dwa główne składniki: kofaktor, który może być jonem metalicznym (nieorganicznym) lub cząsteczką organiczną; Apoenzym, część białka.
[TOC]
Charakterystyka holoenzymów
Utworzone przez zwolenników i kofaktorów
Wspieranie to część białka kompleksu, a kofakory mogą być jonami organicznymi lub cząsteczkami.
Przyznaj różnorodność kofaktorów
Istnieją różne rodzaje kofaktorów, które pomagają tworzyć holoenzymy. Niektóre przykłady to koenzymy i wspólne witaminy, na przykład: witamina B, FAD, NAD+, witamina C T koenzym A.
Niektóre kofaktory z jonami metali, na przykład: miedź, żelazo, cynk, wapń i magnez,. Innym rodzajem kofaktorów są grupy protetyczne SAK.
Związek czasowy lub stały
Kofaktory mogą zjednoczyć wsparcie z różną intensywnością. W niektórych przypadkach związek jest słaby i tymczasowy, podczas gdy w innych przypadkach związek jest tak silny, że jest trwałe.
W przypadkach, w których związek jest tymczasowy, gdy kofaktor jest wyeliminowany z holoenzymu, staje się znów wsparciem i przestaje być aktywny.
Funkcjonować
Holoenzym jest enzymem gotowym do wykonania swojej funkcji katalitycznej; to znaczy, aby przyspieszyć niektóre reakcje chemiczne, które są generowane w różnych obszarach.
Funkcje mogą się różnić w zależności od konkretnego działania holoenzymu. Wśród najważniejszych stojaków polimeraza DNA, której funkcją jest upewnienie się, że kopia DNA jest wykonywana poprawnie.
Może ci służyć: Ardipithecus: odkrycie, cechy, czaszkaPrzykłady wspólnych holoenzymów
Polimeraza RNA
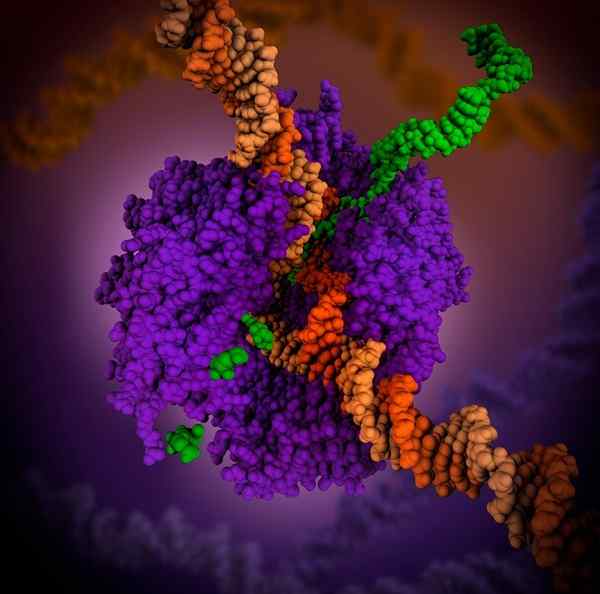 3D RNA polimerazy. Źródło: Maria Voigt., CC przez 4.0, Via Wikimedia Commons
3D RNA polimerazy. Źródło: Maria Voigt., CC przez 4.0, Via Wikimedia Commons Polimeraza RNA jest holoenzymem, który katalizuje reakcję syntezy RNA. Ten holoenzym jest niezbędny do budowy łańcuchów RNA z łańcuchów pleśni DNA, które działają jako szablony podczas procesu transkrypcji.
Jego funkcją jest dodanie rybonukleotydów na końcu 3 rosnącej cząsteczki RNA. W prokariotach wsparcie polimerazy RNA potrzebuje kofaktor o nazwie Sigma 70.
Polimeraza DNA
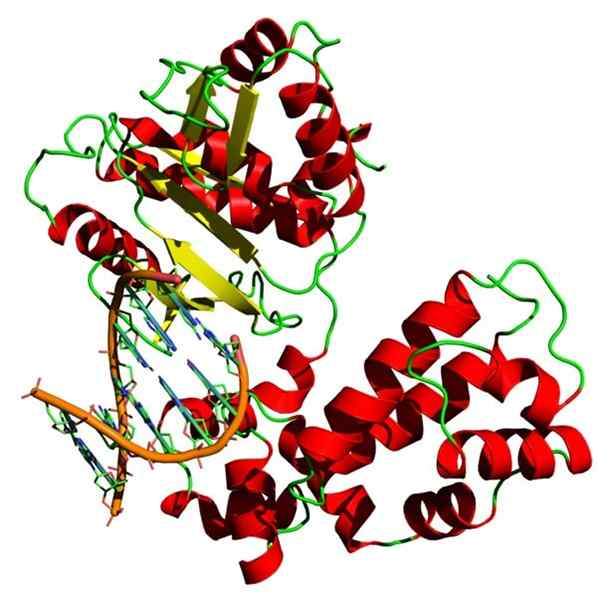 Homiens homo sapiens beta beta DNA struktura. Źródło: Yikrazuul, CC BY-SA 3.0, Via Wikimedia Commons
Homiens homo sapiens beta beta DNA struktura. Źródło: Yikrazuul, CC BY-SA 3.0, Via Wikimedia Commons Polimeraza DNA jest również holoenzymem, który katalizuje reakcję polimeryzacji DNA. Ten enzym wypełnia bardzo ważną funkcję dla komórek, ponieważ jest odpowiedzialny za replikację informacji genetycznych.
Polimeraza DNA potrzebuje jonu z ładunkiem dodatnim, normalnie magnezu, aby móc wykonywać swoją funkcję.
Istnieje kilka rodzajów polimerazy DNA: polimeraza DNA III jest holoenzymem, który ma dwa centralne enzymy (Pol III), każdy związek trzech podjednostek (α, ɛ i θ), zaciska ślizgowa, która ma dwie podjednostki beta i kompleks obciążenia. ustawienie, które ma wiele podjednostek (δ, τ, γ, ψ i χ).
Anhydraza węglowa
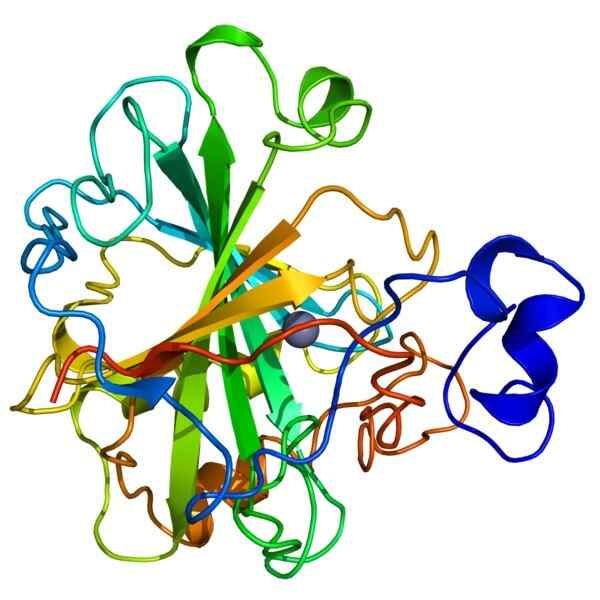 Struktura anhydrazy węglowej
Struktura anhydrazy węglowej Anhydraza węglowa, zwana również odwodnieniem węglanu, należy do rodziny holoenzymów, które katalizują szybką konwersję dwutlenku węgla (CO₂) i wody (H20) w wodorowęglanu (H2CO3) i protonach (H+).
Enzym wymaga jonu cynku (Zn+2) jako kofaktora do wykonania swojej funkcji. Reakcja katalizowana przez anhydrazę węglową jest odwracalna, z tego powodu jej aktywność jest uważana za ważną, ponieważ pomaga utrzymać równowagę kwasową między krwią a tkankami.
Hemoglobina
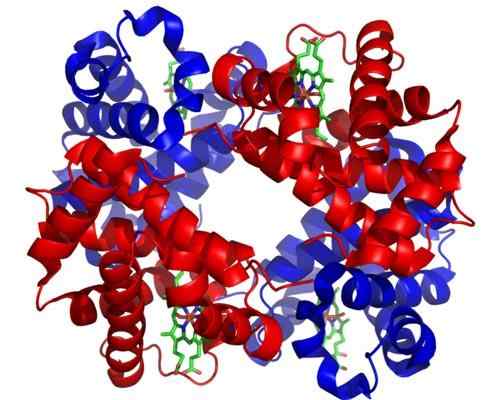 Hemoglobina
Hemoglobina Hemoglobina jest bardzo ważnym holoenzymem do transportu gazu w tkankach zwierzęcych. Białko obecne w czerwonych krwinkach zawiera żelazo (Fe+2), a jego funkcją jest transport tlenu z płuc do innych obszarów ciała.
Może ci służyć: organizmy fotosyntetyczneStruktura molekularna hemoglobiny jest tetramerem, co oznacza, że składa się z 4 łańcuchów polipeptydowych lub podjednostek.
Każda podjednostka tego holoenzymu zawiera grupę hemo, a każda grupa hemo zawiera atom żelaza, który może łączyć cząsteczki tlenu. Grupa hemoglobinowa jest grupą protetyczną, niezbędną do funkcji katalitycznej.
Oksydaza cytochromu
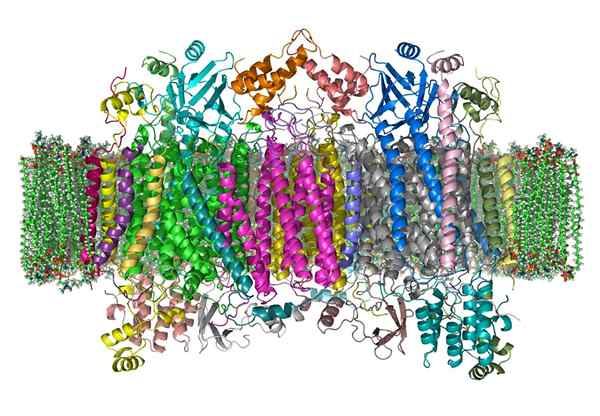 Oksydaza cytochromu
Oksydaza cytochromu Cytochrom oksydazy jest enzymem, który uczestniczy w procesach uzyskiwania energii, które są przeprowadzane w mitochondriach prawie wszystkich żywych istot.
Jest to złożony holoenzym, który wymaga współpracy niektórych kofaktorów, jonów żelaza i miedzi, w celu katalizowania reakcji transferu elektronów i produkcji ATP.
Kinaza pirogronianowa
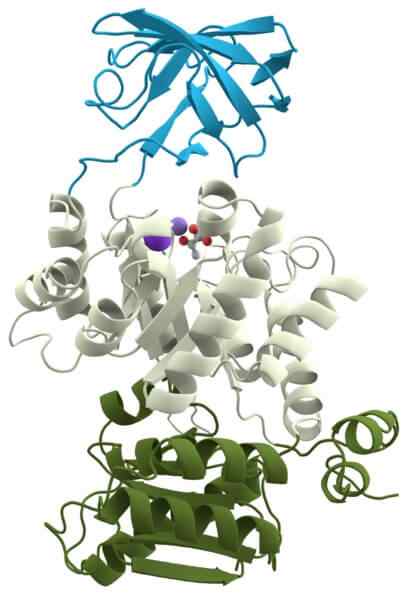 Oksydaza cytochromu
Oksydaza cytochromu Pyrogronian kinazy jest kolejnym ważnym holoenzymem dla wszystkich komórek, ponieważ uczestniczy w jednej z uniwersalnych tras metabolicznych: glikolizy.
Jego funkcją jest katalizowanie przeniesienia grupy fosforanowej cząsteczki zwanej fosfoenolopyrogronianem do innej cząsteczki zwanej adenozyną difosforanową, w celu utworzenia ATP i pirogronianu.
Obsługa wymaga kationów potasowych (k ') i magnezu (mg+2) jako kofaktorów z tworzenia funkcjonalnego holoenzymu.
Pyrogronian karboksylazy
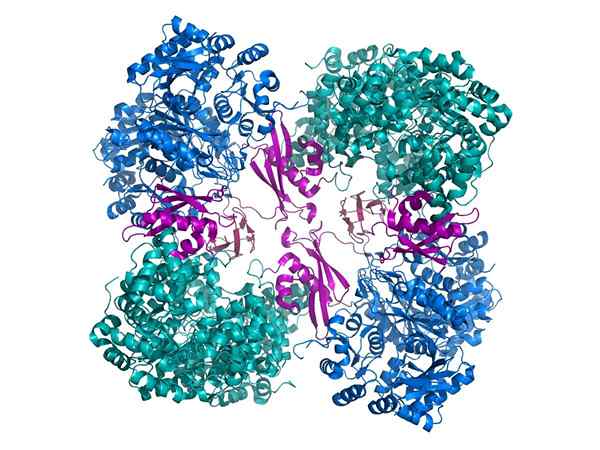 Pyrogronian karboksylazy
Pyrogronian karboksylazy Innym ważnym przykładem jest pirogronian karboksylazy, holoenzy. Zatem pirogronian staje się szczawikiem, ważnym pośrednikiem w metabolizmie.
Aby być funkcjonalnie aktywnym, pirawian FOOSE -karboksylazy wymaga kofaktora zwanego biotyną.
Acetylowa karboksylaza COA
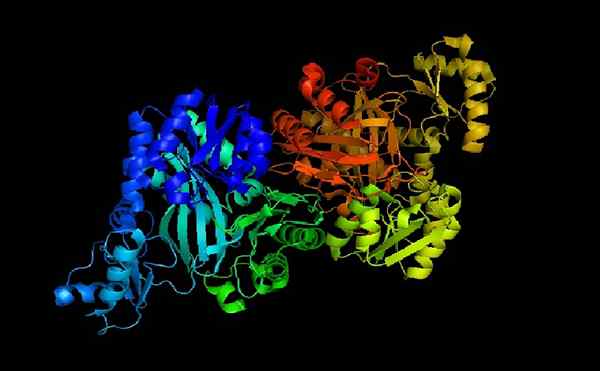 Acetyl COA karboksylaza e-coli
Acetyl COA karboksylaza e-coli Acetylo-CoA Carboxilaza to holoenzym, którego kofaktor, jak wskazano jego nazwa, jest koenzymem.
Gdy apoenzym i koenzym A są sprzężone, holoenzym jest katalitycznie aktywny do wykonania swojej funkcji: przenieś grupę karboksylową na acetylo-CoA, aby zamienić ją w koenzym malonylu A (malonylo-CoA).
Może ci służyć: curl: kompozycja, części, znaczenieAcetylo-CoA pełni ważne funkcje zarówno w komórkach zwierzęcych, jak i komórkach roślinnych.
Oksydaza monoamina
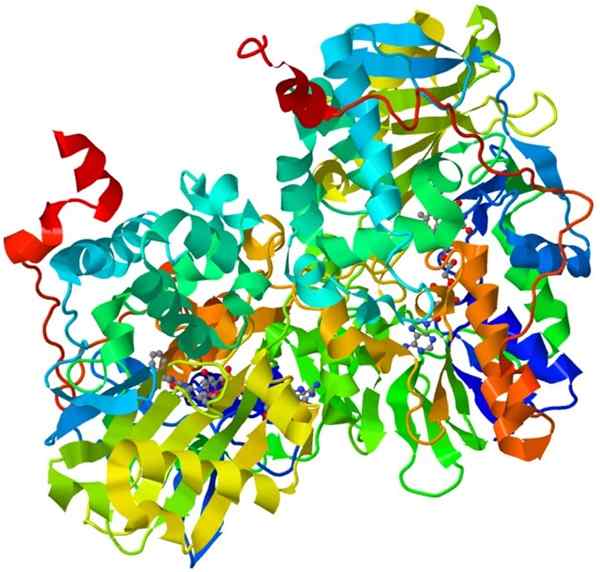 Struktura monoaminy oksydazy
Struktura monoaminy oksydazy Jest to ważny holoenzym w ludzkim układzie nerwowym, jego funkcją jest promowanie degradacji niektórych neuroprzekaźników.
Aby monoamina oksydazy była aktywna katalitycznie, musi kowalencyjnie zjednoczyć swój kofaktor, flawin i adeninę dinukleotyd (FAD).
Dehydrogenaza mleczanowa
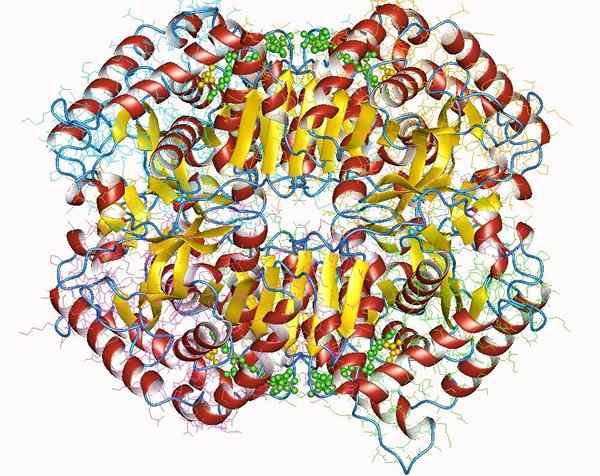 Dehydrogenaza mleczanowa
Dehydrogenaza mleczanowa Dehydrogenaza mleczanowa jest ważnym holoenzymem dla wszystkich żywych istot, szczególnie w tkankach, które zużywają dużo energii, takich jak serce, mózg, wątroba, mięsień szkieletowy, płuca, między innymi.
Ten enzym wymaga obecności jego kofaktora, nikotynamidu i adeniny (NAD), aby katalizować reakcję konwersji pirogronianu mleczanu.
Katalaza
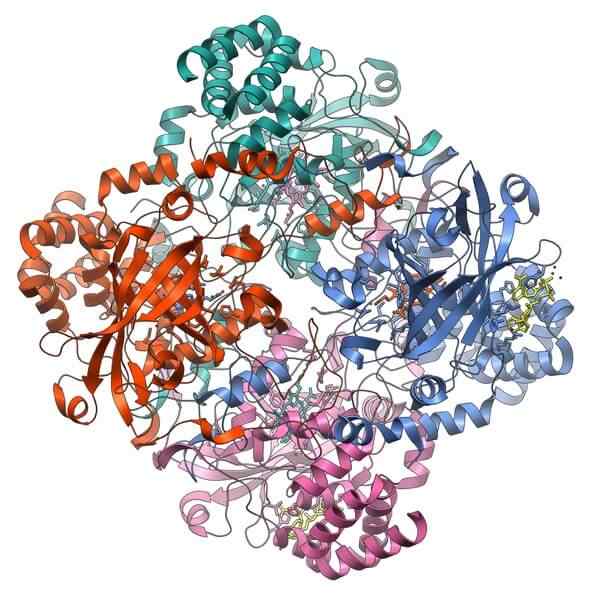 Struktura białka katalazy. Źródło: Vossman, CC BY-SA 3.0, Via Wikimedia Commons
Struktura białka katalazy. Źródło: Vossman, CC BY-SA 3.0, Via Wikimedia Commons Katalaza jest ważnym holoenzymem w zapobieganiu toksyczności komórkowej. Jego funkcją jest rozkład nadtlenku wodoru, produkt metabolizmu komórkowego, tlenu i wody.
Wsparcie katalazy wymaga aktywacji dwóch kofaktorów: jonu manganu i grupy protetycznej hemo, podobnej do hemoglobiny.
Bibliografia
- Athappilly, f. K., & Hendrickson, w. DO. (1995). Struktura domeny biotynylowej acetylo-koenzymu karboksylaza określona przez szalone fazowanie. Struktura, 3(12), 1407-1419.
- Berg, J., Tymoczko, J., Gatto, g. & Strayer, L. (2015). Biochemia (8 wyd.). W. H. Freeman and Company.
- Fegler, J. (1944). Funkcja anhydrazy węglowej we krwi. Natura, 137-38.
- Gaweska, godz., & Fitzpatrick, P. F. (2011). Struktury i mechanizm rodziny oksydazy monoaminy. Pojęcia biomolekularne, 2(5), 365-377.
- Gupta, v., & Bamezai, r. N. K. (2010). Ludzka kinaza pirogronianowa M2: wielofunkcyjne białko. Białko naukowe, 19(11), 2031-2044.
- Jitrapakdee, s., St Maurice, m., Rayment, ja., Cleland, w. W., Wallace, J. C., & Atwood, P. V. (2008). Struktura, mechanizm i regulacja karboksylazy pirogronianowej. Journal Biochemical, 413(3), 369-387.
- Muirhead, h. (1990). Izoenzymy kinazy pirogronianowej. Transakcje społeczeństwa biochemicznego, 18, 193–196.

