Charakterystyka histydyny, struktura, funkcje, jedzenie
- 3709
- 699
- Filip Augustyn
Histydyna (Jego, h) Jest to aminokwas, który jest stosowany do syntezy białek. Jest to cząsteczka hydrofilowa, więc jest ogólnie zorientowana na zewnątrz struktur białkowych, gdy znajdują się w ciekłej pożywce.
Jest uważany za niezbędny aminokwas dla rosnących dzieci, ponieważ go nie produkują. U osoby dorosłej występuje niewielka produkcja histydyny, ale niewystarczające jest dostarczanie dziennych wymagań, więc jest uważana za półsenne aminokwasowe.
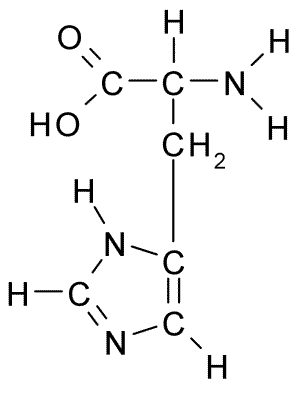
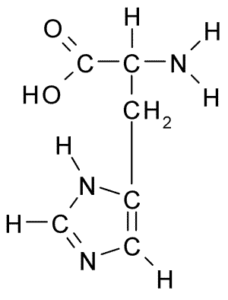 Struktura chemiczna aminokwasu histydyny (źródło: Borb, Via Wikimedia Commons)
Struktura chemiczna aminokwasu histydyny (źródło: Borb, Via Wikimedia Commons) W przypadku zwierząt i człowieka histydyna jest niezbędnym lub co najmniej półsennym aminokwasem, jednak rośliny, grzyby i mikroorganizmy skutecznie wytwarzają histydynę, której potrzebują i są częścią diety histydyny, oprócz zwierząt z białkami.
Histydyna wypełnia bardzo ważne funkcje fizjologiczne w istocie człowieka, takie jak: funkcje bycia częścią aktywnych centrów wielu enzymów, uczestniczących we wzroście, w układzie odpornościowym i tworzeniu mielininy we włóknach nerwowych, między innymi.
Biosynteza histydyny jest złożonym procesem, który ma miejsce głównie w wątrobie i wymaga od 9 do 11 etapów enzymatycznych. Jego degradacja występuje w wątrobie i skórze i przechodzi przez tworzenie się glutaminianu, a następnie podążając różnymi ścieżkami.
Wiele pokarmów jest bogatych w histydynę, takie jak białka zwierzęce, takie jak mięso i produkty mleczne, a także białka roślinne. Zapewniają one wiele codziennych wymagań histydyny, które nasze ciało musi działać prawidłowo.
Deficyt lub nadmiar histydyny spowodowany odziedziczeniem problemów metabolicznych lub transportowych lub niepowodzeniem diety w spożyciu są związane z niektórymi ważnymi problemami, które wpływają na zdrowie zarówno u dzieci, jak i dorosłych. Wystarczające zużycie histydyny pozwala w większości przypadków utrzymanie zdrowego i zdrowego życia.
[TOC]
Charakterystyka
Podświetlającą cechą histydyny jest to, że można ją przekształcić w histaminę, substancję, która aktywnie uczestniczy w wielu reakcjach alergicznych i zapalnych.
U ryb narażonych na środowisko bez wystarczającego chłodzenia bakterie mogą przekształcić histydynę w histaminę i dlatego po spożyciu powodują zatrucie pokarmowe.
Kolejną cechą tego aminokwasu jest to, że jest to jeden z niewielu, wśród istniejących 22, w zakresie fizjologicznego pH (około 7.4) Jest jonizowany i dlatego może aktywnie uczestniczyć w miejscu katalitycznym wielu enzymów.
W cząsteczce hemoglobiny proksymalna histydyna jest jednym z ligandów grupy hemo. Innymi słowy, ten aminokwas uczestniczy w funkcji transportu tlenu hemoglobiny i jest niezbędny do syntezy tego białka, a także do mioglobiny, która jest również znana jako „hemoglobina mięśni”.
Struktura
Histydyna jest aminokwasem Hydrofilowy polarny niezbędny, sklasyfikowane w niezbędnych aminokwasach, ponieważ nie mogą być syntetyzowane przez zwierzęta. Jednak, jak wspomniano wcześniej, jest syntetyzowany przez bakterie, grzyby i rośliny.
U rosnących dzieci histydyna jest absolutnie konieczna; Dorosły może to zsyntetyzować, ale nie jest jasne, czy obejmuje to codzienne potrzeby histydyny, więc musi być połknięte dietą.
Podobnie jak wszystkie aminokwasy, histydyna ma węgiel α, do którego połączono grupę aminową, grupę karboksylową, atom wodoru i łańcuch boczny.
Może ci służyć: Coxiella purnetiiBoczny łańcuch tego aminokwasu powstaje przez pierścień imidazolu, który do fizjologicznego pH protony i nabywa obciążenie dodatnie i nazywa się ”Imidazolio " Skrócony jako IMH+.
Wraz z lizyną i argininą histydyna tworzy grupę podstawowych aminokwasów. Spośród trzech histydyny jest najmniej podstawowa, a jej pierścień imididoólica może być niezabezpieczony do pH blisko 6.
Ponieważ fizjologiczna histydyna pH może wymieniać protony, zwykle uczestniczy to w katalizie enzymatycznej, która wymaga przeniesienia protonów. Ponadto, ponieważ jest to aminokwas polarny, zwykle występuje na zewnętrznej powierzchni białek, gdzie może on hydratować się w pożywce wodnej.
Funkcje
W ramach aktywnej witryny enzymatycznej
Histydyna jest niezbędna do syntezy wielu białek, zwłaszcza enzymów, których aktywne centra mają ten aminokwas. Jest częścią aktywnego centrum aldlasów ssaków, gdzie działa jako dawca protonu.
Znajduje się w aktywnym centrum karboksipeptydazy A, enzymie trzustki, który ma aktywne miejsce utworzone przez Zn i histydynę. W fosfoglikanerie enzymu glikolitu Mutasa Istnieją dwa odpady histydyny w jego aktywnym centrum, które działają jako akceptory lub dawcy grup fosforylowych.
Stwierdzono go również w aktywnym miejscu enzymów, takich jak dehydrogenaza 3-fosforanu gliceraldehydowego, dehydrogenaza mleczanowa, papaina, chimotrypsyna, rnasa a i histydyna liasa (histydyaza). Ponadto jest inhibitorem enzymu syntetaza glutaminy.
Inne funkcje
Ten aminokwas ma ogromne znaczenie dla organizmu, ponieważ jego dekarboksylaza histydyna dekarn.
Histydyna jest wytwarzana przez neurony ośrodkowego układu nerwowego z funkcjami neuromodulacyjnymi.
Jest to konieczne do tworzenia strąków mielinowych włókien nerwowych, więc spełnia ważną rolę w transmisji impulsów elektrycznych.
Wraz z hormonem wzrostu i innymi aminokwasami histydyna przyczynia się do mechanizmów naprawy tkanek, głównie w układzie sercowo -naczyniowym.
Niektóre dodatkowe funkcje obejmują:
- Przyczynia się do detoksykacji niektórych metali ciężkich, ponieważ działa jak chelating.
- Chroni przed uszkodzeniami spowodowanymi przez promieniowanie.
- Uczestniczyć w tworzeniu czerwonych i białych krwinek.
- Jest to konieczne do tworzenia hemoglobiny.
- Pomaga w walce z pewnymi negatywnymi skutkami reumatoidalnego zapalenia stawów, takich jak zapalenie i brak ruchliwości.
- Jest to ważny aminokwas do regeneracji naczyń włosowatych, wzrostu i funkcji seksualnej.
Carnozyna, anserina i homokozyna to dipéptiddy utworzone z histydyny. Pierwsze dwa znajdują się w mięśniach i mają ważne funkcje, takie jak tamponery i aktywatory miozyny atasa.
Homokozyna jest wytwarzana w mózgu w ilościach 100 razy wyższa niż mięśnie szkieletowe mięsiste.
Biosynteza
Histydyna uzyskuje swój gazowany szkielet z 5-fosforanu rybozy. W bakteriach I. Coli, Ten aminokwas występuje ze wspomnianego związku za pomocą 11 etapów enzymatycznych:
- Pierwszy etap syntezy polega na przeniesieniu fosforribozylu z ATP do węgla 1 rybozy 5-fosforanowej, generując 5-fosforribozylo-1-pirofosforanu (PRPP) (PRPP) (PRPP). Enzym syntetaza fosforribozylo-pirofosforanu (syntaza PRPP) katalizuje tę reakcję.
- Następnie występuje przeniesienie grupy pirofosforanu węgla do N-1 ATP, a N1- występuje (5'-fosforribozylo) -ATP. Enzym, który katalizuje tę reakcję, jest fosforozeltransferaza ATP.
- Przez działanie fosforribozyl-top-pirofosforanu hydroksylazy α, β-piofosforan ATP to hydroksylaza i powstaje N1-.
- Hydroksylaza enzymu fosforribozyl-mapa otwiera pierścień purynowy między N-1 i C-6, a rybonukleotyd powstaje N1- (5'-fosforribosil formimino) -5-aminoimidazol-4-karboksamid-1-lribonukleotyd.
- Następnie otwierany jest pierścień rybofuranosowy, który pochodzi z PRPP i jest izomeryzowany na ketozę, tworząc n1- (5'-fosforribozylowe formimina) -5-aminoimidazol-4-karboksamid-1-lribonukleotyd.
- Enzym aminotransferazy przenosi grupę glutaminy, która staje się glutaminianem, i rozbija łącze formiminy, więc jest uwalniany 5-aminoimidazol-karboksamid-1-lribonukleotyd.
- Cząsteczka wody fosforanu imidazolu-glicerolu jest eliminowana za pomocą dehydratazy fosforanu imidazolu-glicerolu i tworzy fosforan imidazol-acetol.
- Fosforan imidazol-acetol jest przenoszony grupę aminową przez fosforan transaminazy histydynolu i powstaje histydynol fosforanu.
- Fosforowa grupa estrowa fosforanu histydynolu z wytworzeniem histydynolu jest hydrolizowana. Fosforan histydynolu fosforan fosforan katalizuje tę reakcję.
- Później histydynol utlenia się przez dehydrogenazę histydynolu i ma histydinalny.
- Ta sama histydynolu dehydrogenaza utlenia się do histydynowego i sprawia, że histydyna.
Pierwszy enzym biosyntetycznej trasy histydyny jest hamowany przez iloczyn trasy, to znaczy histydyna uczestniczą w instrumencie fosforribozylotransferazy ATP, która reprezentuje główny mechanizm regulacji trasy.
Degradacja
Histydyna, prolina, glutaminian, arginina i glutamina są aminokwasami, które, gdy kończą się α-Zotoglurate. Cztery z nich najpierw stają się glutaminianem, który z powodu transaminacji powoduje α-ketoglutorowanie.
Histydyna, poprzez histydynazę, traci grupę α-amino, aby stać się urokanato. Następnie Urocanaza nawilża pozycje 1 i 4 Urocanato, tworząc propionian 4-midazolonu-5. Następnie występuje grupa Imino 4-midazolonu-5-propionato, tworząc N-formiminoglutamato.
Ostatnia reakcja implikuje przeniesienie formylu z N-formyminoglutaminianu do tetrahydrofolanu, który działa z enzymem glutaminianowym transfer. Końcowe produkty tej reakcji to glutaminian i n5-formimino tetrahydrofolan.
Α-ketoglutaran powstaje przez transaminację glutaminianu. Α-ketoglutaran jest pośrednikiem cyklu Krebsa i może również wejść na glukoneogenną trasę do tworzenia glukozy.
Grupa glutamato amino wchodzi do cyklu produkcyjnego mocznika, który ma zostać wyeliminowany przez mocz. Wszystkie te reakcje występują w wątrobie i ich części na skórze.
Pokarmy bogate w histydynę
Dzienne potrzeby histydyny wynoszą około 10 do 11 mg na kg masy ciała, dziennie. U rosnących dzieci histydyna jest niezbędnym aminokwasem, który musi być dostarczany z dietą.
U innych zwierząt histydyna jest również niezbędnym aminokwasem, a te, które są wychowywane w stajniach, powinny otrzymać histydynę w celu utrzymania normalnego poziomu hemoglobiny.
Wśród pokarmów bogatych w histydynę są:
- Wołowina, jagnięcina, wieprzowina, kurczak i indyk. Występuje również u ryb, takich jak tuńczyk (nawet w puszkach), łosoś, pstrąg, pargo i Lubina, a także w niektórych owocach morza.
Może ci służyć: kultura krwi: po co to jest fundament, procedura, wyniki- Mleko i jego pochodne, szczególnie w dojrzałej serach, takich jak między innymi Parmesan, Gruyere, Szwajcarski ser, Gouda. W tubylcach, w surowicy, w jogurcie i kwaśnym śmietanie.
- Soja i orzechy, takie jak orzechy i nasiona. W słoneczniku, dyni, arbuza, sezamie, migdałach, pistacji, masła orzechowym i chia.
- Jajka i fasola lub biała fasola.
- Ziarna pełne, takie jak komosa ryżowa, pszenica, integralny ryż itp.
Korzyści z Twojego spożycia
Istnieje wiele chorób patologicznych, w których histydyna może być przydatna jako adiuwant do leczenia.
Wśród tych patologii możemy nazwać reumatoidalne zapalenie stawów, nadciśnienie tętnicze (ponieważ opisano hipotensywne działanie histydyny), w infekcjach, błyskotliwości i płci i słuchu, wrzodach i niedokrwistościach.
W skórze degradacja spożywanej histydyny wytwarza kwas urokanowy, który jest w stanie chronić skórę, ponieważ pochłania promienie ultrafioletowe.
Nadmierna konsumpcja przez zdrowe osoby nie powoduje poważnych zmian, ponieważ jest szybko zdegradowana. Jednak stosowanie suplementów diety histydyny u pacjentów z ciężką wątrobą i/lub problemami nerek powinno być ograniczone.
Zaburzenia niedoboru
Deficyt histydyny jest związany ze zmianami odpowiedzi immunologicznej.
Zgłoszono również problemy z kościami, głuchota i niedokrwistość związane z deficytem histydyny.
Choroba Hartnupa jest stanem dziedzicznym, który wpływa na transport histydyny i tryptofanu przez błonę śluzową cienkiej jelita i nerków, co powoduje deficyt obu aminokwasów.
Najbardziej istotnymi objawami klinicznymi są pojawienie się zmian schegous i czerwonych w skórze po ekspozycji na słońce, różne stopnie zmiany ruchu i niektóre objawy chorób psychicznych.
Histydynemia jest autosomową chorobą recesywną, która charakteryzuje się deficytem enzymu histydazy, który powoduje wzrost stężenia histydyny we krwi i moczu.
W konsekwencji ci pacjenci nie mogą degradować histydyny do kwasu urokalnego w wątrobie i skórze. Tej chorobie towarzyszy umiarkowane upośledzenie umysłowe, wady mowy i pamięć słuchowa bez głuchoty.
Ograniczenie spożycia histydyny jako leczenia nie było skuteczne w generowaniu poprawy klinicznej i pociąga za sobą ryzyko generowania zaburzeń wzrostu u dzieci dotkniętych tą chorobą.
Bibliografia
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biochemia (3 wyd.). San Francisco, Kalifornia: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Nelson, zm. L., & Cox, m. M. (2009). Zasady biochemii lehninger. Omega Editions (Ed.). doi.org
- Perecarz, s. 1., Farri, L., & Papageorgiou, a. (1983). Wpływ ludzkiego mleka i wzorów niskobiałkowych na szybkości całkowitego przesunięcia białka ciała i wydalania 3-metylohistydyny w moczu. Nauka kliniczna, 64, 611-616.
- Piosenka, ur. C., Joo, n., Aldini, g., & Yeum, k. (2014). Biologiczna funkcja histydyny-dipeptydów i zespołu metabolicznego. Badania i praktyka żywieniowa, 8(1), 3-10.

