Właściwości tlenu, struktura, ryzyko, używa

- 2482
- 2
- Matylda Duda
On tlen Jest to element chemiczny reprezentowany przez symbol lub. Jest to bardzo reaktywny gaz, który Heads Group 16: The Calcogens. Ta nazwa jest powodem, ponieważ siarka i tlen są obecne w prawie wszystkich minerałach.
Jego wysoka elektrooniczność tłumaczy jego wielką awidność przez elektrony, co prowadzi do połączenia z dużą liczbą pierwiastków; W ten sposób powstaje szeroki zakres tlenków mineralnych, które wzbogacają skorupę Ziemi. Zatem pozostały tlen komponuje się i sprawia, że atmosfera jest oddychająca.
 Tlen jest zwykle synonimem powietrza i wody, ale znajduje się również w skałach i minerałach. Źródło: Pxhere.
Tlen jest zwykle synonimem powietrza i wody, ale znajduje się również w skałach i minerałach. Źródło: Pxhere. Tlen jest trzecim elementem obfitości we wszechświecie, za wodorem i helem, a także głównym składnikiem kory Ziemi. Ma procent objętości 20,8% atmosfery Ziemi i stanowi 89% masy wody.
Zwykle ma dwie postacie alotropowe: tlen diatomowy (lub2), który jest najczęstszym sposobem w naturze i ozonem (lub3), znalezione w stratosferze. Są jednak dwa inne (lub4 I8), które istnieją w fazie ciekłej lub stałej i pod ogromnym ciśnieniem.
Tlen jest stale wytwarzany w procesie fotosyntezy, wykonywanym przez fitoplankton i rośliny naziemne. Po wyprodukowaniu zostaje zwolniony, aby żywe istoty mogły z niego korzystać, podczas gdy niewielka część rozpuszcza się na morzach, wspierając życie wodne.
Jest to zatem niezbędny element żywych istot; Nie tylko dlatego, że jest obecny w większości związków i cząsteczek, które je tworzą, ale także interweniują we wszystkich procesach metabolicznych.
Chociaż kontrowersyjnie jego izolacji przypisuje się Carlowi Scheelemu i Josephowi Priestleyowi w 1774 r., Istnieją oznaki, że tlen został faktycznie izolowany po raz pierwszy w 1608 r., Michael Sendivogius.
Ten gaz jest wykorzystywany w praktyce medycznej w celu poprawy warunków życia pacjentów z trudnościami oddechowymi. Podobnie tlen służy, aby umożliwić ludziom pełne funkcje w środowiskach, w których istnieje zmniejszenie lub brak dostępu do tlenu atmosferycznego.
Tlen produkowany w handlu jest stosowany głównie w przemyśle metalurgicznym do konwersji żelaza w stal.
[TOC]
Historia
Duch nitroarialny
W 1500 r. C., Doszedł do wniosku, że część powietrza została pochłonięta podczas spalania i oddychania.
W 1608 r3) Wystąpił gaz. Ten gaz, jak byłoby to znane później, był tlenem; Ale Drebble nie mógł go zidentyfikować jako nowego elementu.
Następnie, w 1668 r., John Majow wskazał, że część powietrza, którą nazwał „Spiritus nitroaerus”, była odpowiedzialna za ogień, i że został również pochłonięty podczas oddychania i spalania substancji. Majow zauważył, że substancje nie uruchomiły się przy braku ducha nitroaria.
Majoow wykonał spalanie antymonu i zaobserwował wzrost wagi antymonu podczas swojego spalania. Następnie Majow doszedł do wniosku, że antymon w połączeniu z duchem nitroarii.
Odkrycie
Chociaż nie otrzymał uznania od społeczności naukowej, w życiu lub po jego śmierci Michael Sandivogius (1604) prawdopodobnie będzie prawdziwym odkrywcą tlenu.
Sandivogius był alchemikiem, filozofem i szwedzkim lekarzem, który wytworzył termiczny rozkład azotanu potasu. Jego eksperymenty doprowadziły go do uwolnienia tlenu, który nazwał „Cibus vitae”: Food of Life.
W latach 1771–1772 szwedzki chemik Carl w Scheele ogrzał kilka związków: azotan potasu, tlenek manganu i tlenek rtęci. Scheele zauważył, że gaz, który zwiększył spalanie, został z nich uwolniony, i do którego nazwał „Air Fire”.
Eksperymenty Josepha Priestly
W 1774 r. Tlenek rtęci uwolnił gaz, który spowodował spalenie świecy znacznie szybciej niż zwykle.
Ponadto Priestly przetestował biologiczny efekt gazu. Aby to zrobić, umieścił w zamkniętym pojemniku mysz, którą spodziewał się przeżyć piętnaście minut; Jednak w obecności gazu przeżył godzinę, więcej niż oszacował.
Priestly opublikował swoje wyniki w 1774 r.; Podczas gdy Scheele zrobił to w 1775 roku. Z tego powodu zwykle przypisuje się odkrycie tlenu dla kapłańskie.
Tlen w powietrzu
Antoine Lavoisier, francuski chemik (1777), odkrył, że powietrze zawiera 20% tlenu i że gdy pali się substancja, w rzeczywistości łączy się z tlenem.
Lavoisier doszedł do wniosku, że pozorne przyrost masy ciała, którego substancje doświadczane podczas spalania było spowodowane utratą masy, która występuje w powietrzu; ponieważ tlen połączony z tymi substancjami, a zatem masy reagentów zostały zachowane.
To pozwoliło Lavoisierowi ustalić prawo ochrony materii. Lavoisier zasugerował nazwę tlenu, który pochodzi od korzeni „Oxys” kwas i geny ”. Wtedy tlen oznacza „kwas poprzedni”.
Ta nazwa jest błędna, ponieważ nie wszystkie kwasy zawierają tlen; Na przykład halogendy wodorowe (HF, HCL, HBR i HI).
Dalton (1810) przypisany do wody wzór chemiczny ho, a zatem masa atomowa tlenu wynosiła 8. Grupa chemikaliów, w tym: Davy (1812) i Berzelius (1814) poprawiły podejście Daltona i doszła do wniosku, że prawidłowa formuła wody wynosi h2O i masa atomowa tlenu wynosi 16.
Może ci służyć: zintegrowana wodaFizyczne i chemiczne właściwości
Wygląd
Bezbarwny, toaletowy i bez smaku gazu; Podczas gdy ozon ma zapach akra. Tlen sprzyja spalaniu, ale samo w sobie nie jest paliwem.
 Ciekł tlen. Źródło: Personel Sgt. Nika Glover, u.S. Siły Powietrzne [domena publiczna]
Ciekł tlen. Źródło: Personel Sgt. Nika Glover, u.S. Siły Powietrzne [domena publiczna] W swojej cieczy (górny obraz) jest jasnoniebieski, a jego kryształy są również niebieskawe; Ale mogą zdobyć różowe, pomarańczowe, a nawet czerwone tony (jak zostanie wyjaśnione w części ich struktury).
Masa atomowa
15 999 u.
Liczba atomowa (z)
8.
Temperatura topnienia
-218,79 ºC.
Punkt wrzenia
-182 962 ºC.
Gęstość
W normalnych warunkach: 1429 g/l. Tlen to najdział najkrótszy gaz niż powietrze. Ponadto jest to zły przewodnik ciepła i prądu. I w temperaturze wrzenia (ciecz) gęstość wynosi 1141 g/ml.
Potrójny punkt
54 361 K i 0,1463 kPa (14,44 atm).
Punkt krytyczny
154 581 K i 5 043 MPa (49770,54 ATM).
Fusion Heat
0,444 kJ/mol.
Ciepło parowe
6,82 kJ/mol.
Pojemność kaloryczna trzonowa
29 378 J/(mol · k).
Ciśnienie pary
W temperaturze 90 K ma ciśnienie pary 986,92 atm.
Stany utleniania
-2, -1, +1, +2. Najważniejszym stanem utleniania jest -2 (lub2-).
Elektronialiczność
3.44 w skali Pauling
Energia jonizacji
Po pierwsze: 1.313,9 kJ/mol.
Drugi: 3.388,3 kJ/mol.
Po trzecie: 5.300,5 kJ/mol.
Zakon magnetyczny
Paramagnetyczny.
Rozpuszczalność wody
Rozpuszczalność tlenu w wodzie maleje wraz ze wzrostem temperatury. Na przykład: 14,6 ml tlenu/L wody rozpuszczane jest w temperaturze 0 ° C i 7,6 ml tlenu/L wody w 20 ° C. Rozpuszczalność tlenu w wodzie pitnej jest większa niż w wodzie morskiej.
W warunkach temperatury 25 ° C i przy ciśnieniu 101,3 kPa woda pitna może zawierać 6,04 ml tlenu/l wody; Podczas gdy woda wód morskich tylko 4,95 ml tlenu/L wody.
Reaktywność
Tlen to wysoce reaktywny gaz, który reaguje bezpośrednio z prawie wszystkimi elementami w temperaturze pokojowej i wysokich temperaturach; z wyjątkiem metali o wyższych potencjałach redukcyjnych niż miedź.
Możesz także reagować ze związkami, utleniając elementy obecne. Tak się dzieje, gdy reaguje na przykład z glukozą, aby wytwarzać wodę i dwutlenek węgla; lub gdy drewno lub węglowodany płonie.
Tlen może akceptować elektrony przez całkowite lub częściowe przeniesienie, więc jest uważany za środek utleniający.
Najczęstszą liczbą utleniania lub stanu utleniania jest -2. Przy tej liczbie utleniania znajduje się w wodzie (h2O), dwutlenek siarki (więc2) i dwutlenek węgla (CO2).
Również w związkach organicznych, takich jak aldehydy, alkohole, kwasy karboksylowe; Wspólne kwasy, takie jak H2południowy zachód4, H2WSPÓŁ3, Hno3; i w swoich pochodnych sole: na2południowy zachód4, Na2WSPÓŁ3 Ok nie3. We wszystkich można założyć istnienie O2- (co nie dotyczy związków organicznych).
Tlenki
Tlen jest obecny jako lub2- W krystalicznych strukturach tlenków metali.
Z drugiej strony w metalowych nadtlenkach, takich jak nadtlenek potasu (Ko2), tlen jest jak jon lub2-. Podczas gdy nad nadtlenkami metali, powiedzieć nadtlenek baru (Bao2), tlen jest przedstawiany jako jon lub22- (BA2+ALBO22-).
Izotopy
Tlen ma trzy stabilne izotopy: 16Lub z 99,76% obfitości; On 17Lub z 0,04%; i 18Lub z 0,20%. Zauważ, że on 16Lub jest to zdecydowanie najbardziej stabilny i obfity izotop.
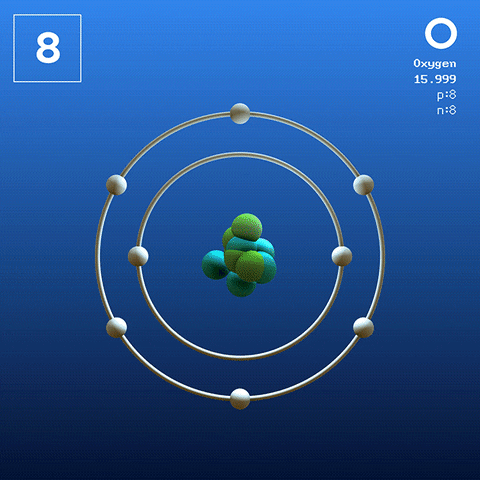
Struktura elektroniczna i konfiguracja
Cząsteczka i interakcje tlenu
 Cząsteczka tlenu dwuatomowa. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Cząsteczka tlenu dwuatomowa. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Tlen w stanie podstawowym jest atomem, którego konfiguracja elektroniczna to:
[On] 2s2 2 p4
Zgodnie z teorią łącza Valencia (TEV) dwa atomy tlenu są połączone kowalencyjnie, aby oba osobno uzupełniają swoje okT w Walencji; Oprócz możliwości kojarzenia dwóch samotnych elektronów orbitali 2p.
W ten sposób pojawia się cząsteczka okrzemkowa tlenu, lub2 (Wyższy obraz), który ma podwójne wiązanie (o = o). Jego stabilność energii jest taka, że tlen nigdy nie występuje jako indywidualne atomy w fazie gazowej, ale jako cząsteczki.
Ponieważ O2 Jest homonuklearny, liniowy i symetryczny, brakuje stałego momentu dipolowego; Dlatego jego interakcje międzycząsteczkowe zależą od masy cząsteczkowej i londyńskich sił dyspersji. Siły te są stosunkowo słabe dla tlenu, co wyjaśnia, dlaczego jest to gaz w warunkach naziemnych.
Jednak gdy temperatura spadnie lub zwiększa ciśnienie, cząsteczki lub2 Są zmuszeni do spójności; do tego stopnia, że ich interakcje stają się znaczące i pozwalają na tworzenie się ciekłego lub stałego tlenu. Aby spróbować je zrozumieć molekularnie, konieczne jest nie tracić z oczu O2 jako jednostka strukturalna.
Ozon
Tlen może przyjmować inne znacznie stabilne struktury molekularne; Oznacza to, że znajduje się w naturze (lub w laboratorium) w różnych formach alotropowych. Ozon (niższy obraz) lub3, Na przykład jest to drugi szczelna część najbardziej znanego tlenu.
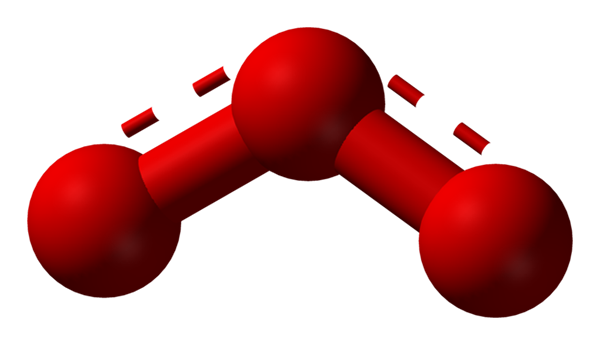 Struktura hybrydy rezonansowej reprezentowana przez model sfery i słupków dla cząsteczki ozonu. Źródło: Ben Mills przez Wikipedia.
Struktura hybrydy rezonansowej reprezentowana przez model sfery i słupków dla cząsteczki ozonu. Źródło: Ben Mills przez Wikipedia. Ponownie TEV trzyma, wyjaśnia i pokazuje, że w OR3 Muszą istnieć struktury rezonansowe, które stabilizują dodatnie obciążenie formalne tlenu środkowego (linie kropkowane na czerwono); Podczas gdy tlen od końca bumerangu rozkłada się obciążenie ujemne, powodując całkowite obciążenie ozonu.
Może ci służyć: Zasady rozpuszczalności: ogólne aspekty i zasadyW ten sposób linki nie są proste, ale nie podwójne. Przykłady hybryd rezonansowych są bardzo powszechne w tak wielu cząsteczkach lub jonach nieorganicznych.
O2 I3, W rezultacie ich struktury molekularne są różne, to samo dotyczy ich właściwości fizycznych i chemicznych, faz cieczy lub kryształów (nawet jeśli oba spożywają atomy tlenu). Teoretyzują, że synteza w dużych skalach cyklicznego ozonu jest prawdopodobna, której struktura przypomina strukturę czerwonawego i natlenionego trójkąta.
Do tej pory pojawiają się „normalne szczeliny” tlenu. Istnieją jednak dwa inne do rozważenia: o4 I8, znalezione lub zaproponowane odpowiednio w tlenu ciekłym i stałym.
Ciekł tlen
Gasowy tlen jest bezbarwny, ale gdy temperatura opada do -183 °. Interakcje między cząsteczkami lub2 Teraz nawet ich elektrony mogą wchłaniać fotony w czerwonym obszarze widma widzialnego, aby odzwierciedlić jego charakterystyczny niebieski kolor.
Jednak teoretycznie, że w tej cieczy jest więcej niż proste cząsteczki lub2, ale także cząsteczka lub4 (niższy obraz). Wygląda na to, że ozon „utknął” kolejny atom tlenu, który w jakiś sposób wstrzymał się nad nowo opisanym formalnym obciążeniem.
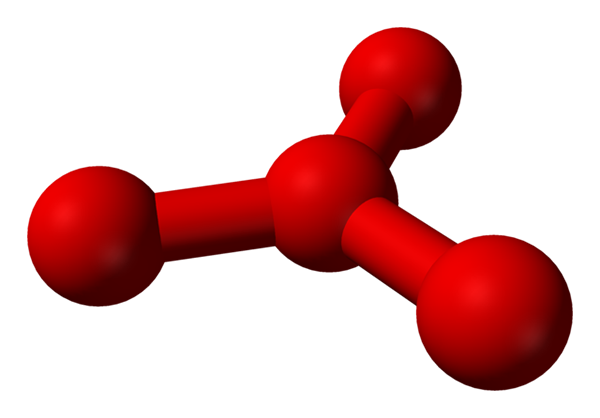 Model zaproponował strukturę z kulkami i słupkami dla cząsteczki tetraoksygenu. Źródło: Benjah-BMM27 [domena publiczna]
Model zaproponował strukturę z kulkami i słupkami dla cząsteczki tetraoksygenu. Źródło: Benjah-BMM27 [domena publiczna] Problem polega na tym, że zgodnie z symulacjami komputerowymi i molekularnymi, powiedział struktura O4 Nie jest dokładnie stabilny; Jednak przewidują, że istnieją jako jednostki (lub2)2, to znaczy dwie cząsteczki o2 Zbliżają się tak bardzo, że tworzą rodzaj nieregularnej ramki (atomy lub nie są ze sobą wyrównane).
Stały tlen
Gdy temperatura opada do -218,79 ° C, tlen krystalizuje się w prostej strukturze sześciennej (faza γ). Gdy temperatura spada jeszcze bardziej, szkło sześcienne cierpi na fazy β (Rhomboédica i przy -229,35 ° C) i α (monokliniczne i w temperaturze -249,35 ºC).
Wszystkie te krystaliczne fazy stałego tlenu występują pod ciśnieniem otoczenia (1 atm). Gdy ciśnienie wzrasta do 9 GPa (~ 9000 atm), pojawia się faza δ, której kryształy są pomarańczowe. Jeśli ciśnienie nadal wzrasta do 10 GPa, czerwony tlen stały pojawia się lub faza ε (ponownie monokliniczna).
Faza ε jest wyjątkowa, ponieważ ciśnienie jest tak ogromne, że cząsteczki lub2 Są nie tylko zakwaterowane jako jednostki lub4, ale także lub8:
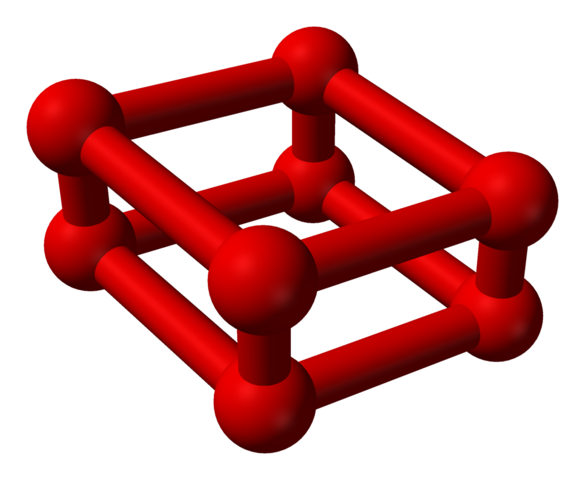 Struktura modelu z kulkami i słupkami dla cząsteczki oksyoksygenu. Źródło: Benjah-BMM27 [domena publiczna]
Struktura modelu z kulkami i słupkami dla cząsteczki oksyoksygenu. Źródło: Benjah-BMM27 [domena publiczna] Zauważ, że to lub8 Składa się z dwóch jednostek lub4 gdzie wyjaśniono już nieregularne ramy. Ważne jest również uznanie go za cztery lub2 ściśle wyrównane i w pozycjach pionowych. Jednak jego stabilność jest taka pod taką presją, że OR4 I8 Są to dwa dodatkowe alotropy do tlenu.
I wreszcie mamy fazę ζ, metaliczne (do ciśnienia większych niż 96 GPa), w której ciśnienie powoduje, że elektrony rozproszone w szkle; Jak w przypadku metali.
Gdzie jest i produkcja
Minerały
Tlen jest w masie trzeci element wszechświata, za wodorem i helem. Stanowi najliczniejszy element skorupy Ziemi, reprezentujący około 50% jej masy. Jest głównie łączony z krzemionem, w postaci tlenku krzemu (Sio2).
Tlen jest częścią niezliczonych minerałów. Podobnie znajduje się jako część wielu związków, takich jak węglany, fosforany, siarczany, azotany itp.
Powietrze
Tlen stanowi 20,8% powietrza atmosferycznego pod względem objętości. W troposferze jest to głównie jak cząsteczka tlenu diatomowa. Podczas gdy w stratosferze warstwa gazowa między 15 a 50 km powierzchni Ziemi jest jak ozon.
Ozon jest wytwarzany przez porażenie elektryczne na cząsteczce O2. Ten wolny tlen pochłania światło ultrafioletowe promieniowania słonecznego, blokując jego szkodliwe działanie na ludzi, co w skrajnych przypadkach wiąże się z pojawieniem się czerniaków.
Świeża i słona woda
Tlen jest głównym składnikiem wody morskiej i słodkiej wody z jezior, rzek i wód gruntowych. Tlen jest częścią chemicznej wzoru wody, masując 89% z nich.
Z drugiej strony, chociaż rozpuszczalność tlenu w wodzie jest stosunkowo niska, ilość rozpuszczonego w tym tlenu jest niezbędna dla życia wodnego, która obejmuje wiele gatunków zwierząt i glonów.
Istoty żywe
Człowiek powstaje, około 60% wody, a jednocześnie bogaty w tlen. Ale ponadto tlen jest częścią wielu związków, takich jak fosforany, węglany, kwasy karboksylowe, ketony itp., które są niezbędne do życia.
Tlen jest również obecny w polisacharydach, lipidach, białkach i kwasach nukleinowych; to znaczy, tak samo podane biologiczne makrocząsteczki.
Jest to również część szkodliwych marnotrawstwa aktywności człowieka, na przykład: dwutlenek węgla i dwutlenek, a także dwutlenek siarki.
Produkcja biologiczna
 Rośliny są odpowiedzialne za wzbogacanie powietrza tlenu w zamian za dwutlenek węgla, który wydychujemy. Źródło: Pexels.
Rośliny są odpowiedzialne za wzbogacanie powietrza tlenu w zamian za dwutlenek węgla, który wydychujemy. Źródło: Pexels. Tlen występuje podczas fotosyntezy, proces, w którym fitoplankton morski i rośliny naziemne wykorzystują energię lekką do reakcji dwutlenku węgla z wodą, powodując glukozę i uwalniając tlen.
Szacuje się, że ponad 55% tlenu wytwarzanego przez fotosyntezę wynika z działania fitoplanktonu morskiego. Dlatego stanowi główne źródło wytwarzania tlenu na Ziemi i jest odpowiedzialny za utrzymanie życia w nim.
Produkcja przemysłowa
Nalekcja powietrzna
Główna metoda produkcji tlenu przemysłowego jest tworzona w 1895 roku, niezależnie przez Karla Paula Gottfrieda von Linde i Williama Hamsona. Ta metoda obecnie stosuje pewne modyfikacje.
Może ci służyć: Butanone: Struktura, właściwości i zastosowaniaProces zaczyna się od kompresji powietrza w celu skondensowania pary wody, a tym samym go wyeliminować. Następnie powietrze jest przesiane po przeprowadzaniu przez mieszaninę żelitu i żelu krzemionkowego, do eliminacji dwutlenku węgla, ciężkich węglowodorów i reszty wody.
Następnie składniki ciekłego powietrza są oddzielone przez destylację ułamkową, osiągając oddzielenie gazów obecnych w różnych temperaturach wrzenia. Ta metoda jest uzyskiwana z 99% czystością.
Elektroliza wody
Tlen jest wytwarzany przez wysoce oczyszczoną elektrolizę wody i przy przewodności elektrycznej, która nie przekracza 1 µs/cm. Woda jest oddzielona przez elektrolizę w swoich komponentach. Wodór, gdy kation porusza się do katody (-); Podczas gdy tlen porusza się w kierunku anody (+).
Elektrody mają specjalną strukturę do zbierania gazów, a następnie wytwarzanie ich upłynnienia.
Rozkład termiczny
Rozkład termiczny związków, takich jak tlenek rtęci i gospodarz (azotan potasu), uwalnia tlen, który można zebrać do użycia. W tym celu stosuje się również nadtlenki.
Artykuł biologiczny
Tlen jest wytwarzany przez fitoplankton i rośliny lądowe poprzez fotosyntezę. Przecina ścianę płucną i we krwi jest wychwytywana przez hemoglobinę, która przenosi ją do różnych narządów, a następnie stosowana w metabolizmie komórki.
W tym procesie tlen jest stosowany podczas metabolizmu węglowodanów, kwasów tłuszczowych i aminokwasów, aby ostatecznie wytwarzać dwutlenek węgla i energię.
Oddychanie może schematyzować w następujący sposób:
C6H12ALBO6 + ALBO2 => Co2 + H2Lub +energia
Glukoza jest metabolizowana w zestawie sekwencyjnych procesów chemicznych, który obejmuje glikolizę, cykl Krebsa, elektroniczny łańcuch transportu i fosforylacja oksydacyjna. Ta seria zdarzeń wytwarza energię, która gromadzi się jako ATP (Tryposforan Adenosín).
ATP jest stosowany w różnych procesach w komórkach, które obejmują transport jonów i innych substancji przez błonę plazmatyczną; wchłanianie substancji w jelicie; skurcz różnych komórek mięśni; Metabolizm różnych cząsteczek itp.
Leukocyty polimorfojądrowe i makrofagowe są komórkami fagocytarnymi, które są zdolne do stosowania tlenu do wytwarzania jonów nadtlenkowych, nadtlenku wodoru i pojedynczego tlenu, które są używane do niszczenia mikroorganizmów.
Ryzyko
Oddychanie tlenu do wysokiego ciśnienia może powodować nudności, zawroty głowy, skurcze mięśni, utrata widzenia, drgawki i utrata przytomności. Ponadto oddychanie czystego tlenu przez długi czas powoduje podrażnienie płuc, objawiane kaszlem i skrócenie oddychania.
Może być również przyczyną tworzenia obrzęku płuc: bardzo poważny stan, który ogranicza funkcję oddechową.
Atmosfera o wysokim stężeniu tlenu może być niebezpieczna, ponieważ ułatwia rozwój pożarów i wybuchów.
Aplikacje
Lekarze
Tlen jest podawany pacjentom z niewydolnością oddechową; Tak jest w przypadku pacjentów dotkniętych zapaleniem płuc, obrzęku płuc lub płuc. Nie mogli oddychać tlenu środowiskowego, ponieważ byłyby poważnie dotknięte.
Pacjenci z niewydolnością serca w tym, co jest prezentowane na akumulację cieczy w pęcherzykach pęcherzyków, również potrzebują dostarczenia tlenu; Podobnie jak pacjenci, którzy doznali ciężkiego wypadku naczyniowego (udar).
Potrzeba zawodowa
Strażacy, którzy walczą o ogień w środowisku z niewłaściwą wentylacją, wymagają użycia masek i butelki tlenu, które pozwalają im pełnić swoje funkcje, nie stawiając życia w większym ryzyku.
Okręty podwodne są wyposażone w sprzęt do produkcji tlenu, który pozwala żeglarzom pozostać w zamkniętym środowisku bez atmosferycznego dostępu do powietrza.
Nurkowie wykonują swoją pracę zanurzoną w wodzie, a zatem izolowani z powietrza atmosferycznego. Oddychają tlenem pompowanym rurkami podłączonymi do ich skanu lub użycia bombardów przymocowanych do ciała łodzi podwodnej.
Astronauci wykonują swoje działania w środowiskach wyposażone w generatory tlenu, które umożliwiają przetrwanie podczas podróży kosmicznych i stacji kosmicznej.
Przemysłowy
Ponad 50% przemysłowo wytwarzanego tlenu jest spożywanych podczas transformacji żelaza w stal. Żelazie wstrzykuje się strumieniem tlenu w celu wyeliminowania obecności siarki i węgla; reaguj na produkcję tak2 i co2, odpowiednio.
Acetylen jest stosowany w połączeniu z tlenem do cięcia płyt metalowych, a także do wytworzenia spawania. Tlen jest również stosowany w produkcji szkła, zwiększając spalanie w jego pieczeniu, aby poprawić jego przezroczystość.
Spektrofotometria absorpcji atomowej
Połączenie acetylenu i tlenu służy do spalania próbek o różnym pochodzeniu w atomowym spektrofotometrze absorpcyjnym.
Podczas zabiegu na wiązkę światła z lampy wpływa płomień, który jest specyficzny dla elementu, który jest pożądany do kwantyfikacji. Płomień pochłania światło lampy, umożliwiając kwantyfikację elementu.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Tlen. Źródło: w:.Wikipedia.org
- Richard Van Noordden. (13 września 2006). Po prostu ładna faza? Solidny czerwony tlen: bezużyteczne, ale zachwycające. Odzyskane z: natury.com
- Azonano. (4 grudnia 2006). Stałą fazę e-fazy tlenu określająca się wzdłuż odkryć klastra tlenu O8. Odzyskane z: Azonano.com
- National Center for Biotechnology Information. (2019). Cząsteczka tlenu. Baza danych Pubchem. CID = 977. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Dr. Doug Stewart. (2019). Fakty elementów tlenu. Chemicool. Odzyskane z: Chemicool.com
- Robert c. Brazy. (9 lipca 2019 r.). Tlen: element chemiczny. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Dzieci wiki. (2019). Rodzina tlenowa: właściwości elementów Via. Odzyskane od: po prostu.Nauka
- Advameg, inc. (2019). Tlen. Odzyskane z: Made How.com
- Lentech b.V. (2019). Tabela okresu: tlen. Odzyskane z: lentech.com
- Departament Zdrowia i Seniorów w New Jersey. (2007). Tlen: Arkusz informacyjny dotyczący substancji niebezpiecznej substancji. [PDF]. Odzyskane z: NJ.Gov
- Yamel Mattarollo. (26 sierpnia 2015). Przemysłowe zastosowania przemysłowe. Odzyskane z: altecdust.com
- « Historia neonów, właściwości, struktura, ryzyko, użycia
- Charakterystyka histydyny, struktura, funkcje, jedzenie »

