Struktura wodorotlenku sodu (NAOH), właściwości, zastosowania, synteza

- 2526
- 367
- Arkady Sawicki
On wodorotlenek sodu Jest to związek nieorganiczny, którego wzorem chemicznym jest NaOH i składa się z bardzo silnej podstawy metalowej lub alkalii. 5 %roztwór w wodzie ma pH blisko 14.
Jest to bardzo higroskopijna biała ciało stałe, które może również pochłaniać dwutlenek węgla powietrza z tworzeniem węglanu sodu. Komerno występuje w plastikowych butelkach, takich jak tabletki, których nie można ujawnić zbyt dużo czasu w powietrzu, ani nie powinny być manipulowane platulami.
 Pigułki wodorotlenkowe sodu na szkle. Źródło: Brak, który można odczytać, nie dostarczył autora. Walkerma założyła (na podstawie roszczeń dotyczących praw autorskich). [Domena publiczna]
Pigułki wodorotlenkowe sodu na szkle. Źródło: Brak, który można odczytać, nie dostarczył autora. Walkerma założyła (na podstawie roszczeń dotyczących praw autorskich). [Domena publiczna] Wodorotlenek sodu można zsyntetyzować podczas reakcji wodorotlenku wapnia z węglanem sodu. Obecnie jest zasadniczo syntetyzowany przez elektrolizę solanki i jest wtórnym produktem produkcji chloru gazowego.
Dawać. Jest również stosowany w czyszczeniu domu, oczyszczaniu wody, przetwarzaniu aluminium, produkcji medycyny itp.; A przede wszystkim jest to wtórny wzór par excellence.
Wodorotlenek sodu jest bardzo żrący, jest w stanie wytwarzać podrażnienie, oparzenia skóry i oczy. Przez wdychanie jego pyłu może powodować obrzęk płuc. Tymczasem jego spożycie może spowodować tak poważne obrażenia przewodu pokarmowego, które mogą prowadzić do śmierci.
[TOC]
Struktura
Bezwodny
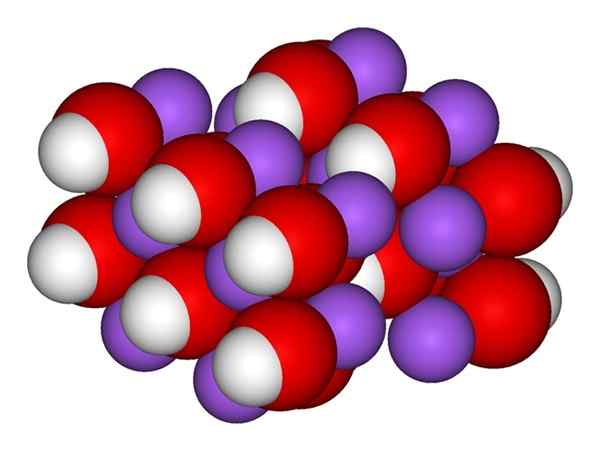
 Jony NaOH. Źródło: Gabriel Bolívar.
Jony NaOH. Źródło: Gabriel Bolívar. Najwyższy obraz pokazuje jony, które składają się naah. Katacja na+ Jest reprezentowany przez fioletową kulę, podczas gdy anion hydroksylowy (wodorotlenek lub oksydril) OH- Dla czerwono -białej kuli. Oba jony NA+ I och- Współdziałają ze sobą przez przyciąganie elektrostatyczne ich przeciwnych obciążeń.
 Struktura wodorotlenku sodu
Struktura wodorotlenku sodu Takie interakcje są nie -kierunkowe, więc atrakcje jonowego na+Oh- może wpływać na innych w określonej odległości. W rezultacie jony NA+ Odpierają się nawzajem, podobnie jak OH-, aż do definiowania minimalnego kryształu energii, w której ustanawiają konstrukcję uporządkowaną i okresową (krystaliczne).
Dlatego pojawia się ortorombowe kryształy anhydro NaOH (bez wody):
 Reprezentacja krystalicznej struktury bezwodnego wodorotlenku sodu. Źródło: Quibik przez Wikipedia.
Reprezentacja krystalicznej struktury bezwodnego wodorotlenku sodu. Źródło: Quibik przez Wikipedia. Jony pozostają wystarczająco spójne, aby bezwodny kryształ NaOH do podstawy 323 ºC (pod warunkiem, że w środowisku nie ma wilgoci).
Hydraty
Oba na+ Jak och- Są jony, które cząsteczki wody łatwo solvetan (hydrat). To sprzyja jego nawodnieniu powyżej energii siatkowej jej kryształów, więc NaOH uwalnia dużo energii, gdy wchodzi w kontakt z wodą.
Może ci służyć: reakcja fehling: preparaty, czynne czynniki, przykłady, zastosowaniaJednak bezwodne kryształy mogą gościć cząsteczki wody bez rozpuszczenia; to znaczy wodorotlenek sodu może tworzyć liczne hydraty, naoh · nh2ALBO. Cząsteczka wody może dobrze uformować most wodorowy z OH- (Hoh-oh-) lub koordynuj z Na+ (Na+-Oh2).
W zależności od proporcji molowej między NaOH i H2Lub może pojawić się monohydrates (naoh · h2O), dihydraty (naoh · 2H2O), trihemakraty (naoh · 3.5h2O), tetrahydrates (naoh · 4h2O), heptahrydy (naoh · 7h2O) i inni.
Każde te hydraty mogą krystalizować z wodnego roztworu NaOH o różnych wartościach masowych i w różnych temperaturach. W związku z tym NaOH wykazuje skomplikowany schemat rozpuszczalności wody.
Ogólnie rzecz biorąc, kryształy hydratów są mniej gęste i mają niższe temperatury topnienia. Wynika to z faktu, że cząsteczki wody „utrudniają” interakcje między Na+ I och-, Dodanie sił dipol-dipolowych w poświęceniu atrakcji jonowych.
Fizyczne i chemiczne właściwości
Nazwy
IUPAC Preferowana nazwa: wodorotlenek sodu. Inne nazwy: soda kaustyczna, Ascarita (mniej powszechna)
Masa cząsteczkowa
39 9971 g/mol
Wygląd
Stałe lub białe, surowe lub nieprzezroczyste kryształy.
Temperatura topnienia
323 ° C
Punkt wrzenia
1.388 ° C
Rozpuszczalność wody
1.000 g/l w temperaturze 25 ° C. To pokazuje, ile może rozpuścić w wodzie.
Jego wodne roztwory są lepkie, z wartością lepkości blisko osiemdziesiąt razy większą niż w przypadku wody, i uwalniają bardzo ciepło na początku. Jeśli masz z nimi kontakt, zmieniają śliską skórę z powodu saponifikacji kwasów tłuszczowych skóry.
Zasadność (PKB)
- 0,56
Ph
Roztwór 5 % P/P w wodzie ma pH blisko 14
Wskaźnik refrakcji (ND)
Przy długości fali 580,4 nm: od 1433 do 320 ° C i od 1421 do 420 ° C.
Stabilność
Pojemniki, które go zawierają, muszą być szczelnie zamknięte, aby zapobiec tworzeniu węglanu sodu. Wynika to z wysokiej higroskopiczności, która prowadzi go do wchłaniania wilgoci jego środowiska i współwłaściciela2.
Rozkład
Po podgrzaniu do rozkładu emituje dym z tlenku sodu.
Punkt samokierowania
To nie jest łatwopalne
Breja
4,0 cpoise w temperaturze 350 ° C
Ciepło parowe
175 kJ/mol A 1.388 ° C
Napięcie powierzchniowe
74,35 dynami/cm w roztworze 2,72 % P/P w wodzie w 18 ° C.
Reaktywność
Z kwasami
Reaguje z organicznymi i nieorganicznymi kwasami mineralnymi, powodując wodę i odpowiadającą sól. W przypadku kwasu siarkowego reakcja jest egzotermiczna.
Może ci służyć: siarczk aluminiowy (AL2S3): struktura, właściwości, zastosowania2 naoh+h2południowy zachód4 => Na2południowy zachód4 + 2 godz2ALBO
Z tlenkami kwasowymi
Reaguje na przykład z dwutlenkiem siarki, podając sól siarczku i wody:
2 naoh +so2 => Na2południowy zachód3 + H2ALBO
Z metali
Jego wodne roztwory reagują na niektóre metale, powodując złożone sole sodu. Na przykład jego reakcja z cynkiem powoduje powstanie cyncato sodu:
Zn + 2 NaOH + 2 H2O => na2[Zn (OH)4] + H2
Synteza
Wodorotlenek sodu jest głównie syntetyzowany dwiema metodami: stosowanie węglanu sodu, początkowo stosowane i elektroliza chlorku sodu, obecnie o większym użyciu przemysłowym.
Reakcja węglanu sodu i wodorotlenek wapnia
Węglan sodu reaguje z wodorotlenkiem wapnia w procesie znanym jako kaustacja:
CA (OH)2 + Na2WSPÓŁ3 => Caco3 + Naoh
Węglan wapnia wytrąca się, pozostawiając wodorotlenek sodu w supernatancie, który jest skoncentrowany przez parowanie.
Węglan sodu wcześniej pochodzi z procesu Solvay:
2 NaCl+ Caco3 => Na2WSPÓŁ3 + Cacl2
Elektroliza chlorku sodu
Elektroliza chlorku sodu, obecna w solance, wytwarza gaz wodorowy, gaz chlorkowy i wodorotlenek sodu w roztworze wodnym:
2 NaCl+2 H2O => h2 + Cl2 + 2 naoh
Komora elektrolityczna składa się z przedziału, w którym anoda (+), metalu tytanowego i miejsca, w którym umieszczona jest solanka. Ten przedział jest oddzielony od przedziału katodowego (-) za pomocą porowatej membrany.
Następująca reakcja występuje w anodzie:
2 Cl- => Cl2 + 2 e- (utlenianie)
Tymczasem ta reakcja występuje w katodzie:
2 godz2O +2 e- => H2 + Oh- (zmniejszenie)
Sód (na+) Rozproszony z przedziału anodowego do katody, przez membranę, która je oddziela, tworząc wodorotlenek sodu.
Aplikacje
Produkty czyszczące
Wodorotlenek sodu jest stosowany do produkcji mydeł i detergentów używanych w domu i w aktywności komercyjnej. Połączenie wodorotlenku sodu i chloru wytwarza wybielacz chloru, stosowany w białym myciu odzieży.
Eliminuje także akumulację tłuszczu w drenażach, powodując jego eliminację poprzez jego konwersję w mydła poprzez proces saponifikacji. Pozwala to na wyeliminowanie utrudniania rur domowych i innych budynków.
Produkty farmaceutyczne i lecznicze
Wodorotlenek sodu stosuje się w opracowaniu wspólnych środków przeciwbólowych, takich jak aspiryna. Również leków o działaniu przeciwzakrzepowym, które blokują tworzenie zakrzepów krwi i leków w celu zmniejszenia hipercholesterolemii.
Procesy energetyczne
Wodorotlenek sodu jest wykorzystywany do produkcji ogniw paliwowych, które działają jako akumulatory do wytwarzania energii elektrycznej do różnych zastosowań, w tym transportu. Żywice epoksydowe, wyprodukowane z interwencją wodorotlenku sodu, stosuje się w turbinach wiatrowych.
Może ci służyć: korozja galwaniczna: mechanizmy, przykłady, ochronaUzdatnianie wody
Wodorotlenek sodu służy do neutralizowania kwasowości wody i przyczynia się do eliminacji jego metali ciężkich. Jest również stosowany do produkcji podchlorynu sodu, środka dezynfekującego wodę.
Wodorotlenek sodu reaguje z siarczanem glinu w celu powstawania wodorotlenku glinu: środka flockulantowego stosowane w obróbce wody w celu zwiększenia sedymentacji cząstek, co powoduje jego wyjaśnienie.
Produkcja papieru
Wodorotlenek sodu jest stosowany z siarczkiem sodu w obróbce drewna w celu uzyskania celulozy w niemal czysty sposób, który tworzy podstawę papieru. Jest również używany w recyklingu papieru, ponieważ pomagając oddzielić atrament, pozwala nam ponownie użyć go.
Produkcji przemysłowej
Wodorotlenek sodu jest stosowany w produkcji Rayón, Spandex, materiałów wybuchowych, żywic epoksydowych, szkła i ceramiki. Jest używany w przemyśle tekstylnym do barwników i przetwarzania tkanin bawełnianych.
W roślinach oczyszczalni trzciny cukrowej wodorotlenek sodu w niskiej temperaturze jest wykorzystywany do produkcji trzciny cukrowej Bagazo.
Ryzyko
Wodorotlenek sodu jest wysoce żrący związkiem, więc może powodować, kontaktując się ze skórą, oparzeniami, ampulsami, a nawet trwałymi bliznami.
W kontakcie z oczami może powodować poważne oparzenia, obrzęk, ból, rozmyte widzenie, aw ciężkich przypadkach może powodować stałą ślepotę.
Spożycie wodorotlenku sodu może powodować oparzenia warg, języka, gardła, przełyku i żołądka. Wśród zwykłych objawów objawiane są nudności, wymioty, skurcze żołądka i biegunki.
Chociaż inhalacja wodorotlenku sodu jest rzadka i może wystąpić tylko z powodu obecności złożonego pyłu w powietrzu lub tworzeniem rosy, która go zawiera, powoduje podrażnienie w płucach.
W przypadku przewlekłego narażenia może to powodować obrzęk płuc i ciężkie skrócenie oddechu, co stanowi awarię medyczną.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Sód wodorotlenkowy. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Sód wodorotlenkowy. Baza danych Pubchem. CID = 14798. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Elementy amerykańskie. (2019). Roztwór wodorotlenku sodu. Pobrano z: Americlements.com
- Fakty bezpieczeństwa chemicznego. (2019). Sód wodorotlenkowy. Odzyskane z: chemicalsafetyfacts.org
- NJ Health. (2015). Sód wodorotlenkowy. [PDF]. Odzyskane z: NJ.Gov
- Canadian Center for Cukutational Health & Bezpieczeństwo. (2019). OSH odpowiada na arkusze faktów: wodorotlenek sodu. Odzyskane z: cohs.AC
- Ausetute. (S.F.). Wodorotlenek sodu i wytwarzanie chloru przez elektrolizę. Odzyskane z: ausetute.com.Au
- « Pochodzenie języka chol, cechy, gdzie mówisz, słowa
- Indeksowane cechy czasopism, kryteria, wpływowe przykłady »

