Struktura wodorotlenku rtęci, właściwości, zastosowania, ryzyko
- 3591
- 1128
- Arkady Sawicki
On Wodorotlenek rtęci Jest to związek nieorganiczny, w którym metal rtęci (HG) ma liczbę utleniania 2+. Jego formuła chemiczna to HG (OH)2. Jednak gatunek ten nie został jeszcze uzyskany w postaci stałej w normalnych warunkach.
Rtęć lub wodorotlenek rtęciowy jest przejściowym pośrednikiem krótkiego życia w tworzeniu tlenku rtęci HGO w roztworze alkalicznym. W badaniach przeprowadzonych w roztworach tlenku tlenku HGO wydedukowano, że HG (OH)2 To słaba baza. Inne towarzyszące mu gatunki to HGOH+ i HG2+.
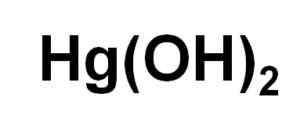 Formuła chemiczna wodorotlenku rtęci (II). Autor: Marilú Stea.
Formuła chemiczna wodorotlenku rtęci (II). Autor: Marilú Stea. Pomimo tego, że niemożność wytrącania się w roztworze wodnym, HG (OH)2 Uzyskano go w reakcji fotochemicznej rtęci z wodorem i tlenem w bardzo niskich temperaturach. Został również uzyskany w postaci koprecipited wraz z wiarą (OH)3, gdzie obecność jonów haluro wywiera wpływ na pH, w którym występuje koprecipitacja.
Ponieważ nie był łatwo uzyskany na poziomie laboratoryjnym, nie było możliwe znalezienie żadnej użyteczności dla tego związku ani określić ryzyko jego użycia. Można jednak wywnioskować, że przedstawia to samo ryzyko, co inne związki rtęciowe.
[TOC]
Struktura cząsteczki
Struktura wodorotlenku rtęci (II) HG (OH)2 Opiera się na liniowej części centralnej utworzonej przez atom rtęci z dwoma atomami tlenu z bokami.
Atomy wodoru są zjednoczone z tą centralną strukturą, każda obok każdego tlenu, który swobodnie obracał się wokół każdego tlenu. Można to reprezentować w prosty sposób, jak wskazano poniżej:
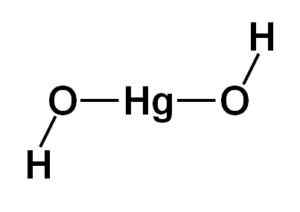 Struktura teoretyczna wodorotlenku rtęci (II). Autor: Marilú Stea
Struktura teoretyczna wodorotlenku rtęci (II). Autor: Marilú Stea Elektroniczna Konfiguracja
Struktura elektroniczna metalicznego rtęci HG jest następująca:
[Xe] 5D10 6S2
gdzie [xe] to elektroniczna konfiguracja szlachetnego gazu ksenon.
Obserwując tę strukturę elektroniczną, uzyskuje się, że najbardziej stabilnym stanem utleniania rtęci jest ten, w którym utracone są 2 elektrony warstwy 6S.
W HG (OH) wodorotlenek rtęciowy2, Atom rtęci (HG) znajduje się w stanie utleniania 2+. Dlatego w HG (OH)2 Merkury ma następującą konfigurację elektroniczną:
Może ci służyć: 30 zastosowań kwasów karboksylowych w życiu codziennym[Xe] 5D10
Nomenklatura
- Wodorotlenek rtęci (ii)
- Wodorotlenek rtęci
- Merkury dihydroksyd
Nieruchomości
Waga molekularna
236,62 g/mol
Właściwości chemiczne
Zgodnie z informacjami, możliwe jest, że HG (OH)2 Być związkiem przejściowym w tworzeniu HGO w środowisku wodnym alkalicznym.
Dodanie jonów hydroksylowych (OH-) do wodnego roztworu z jonami rtęciowymi Hg2+ Prowadzi do wytrącania żółtego stałego tlenku rtęci (II) HGO, z czego Hg (OH)2 Jest to pasażer lub agent tymczasowy.
 Tlenek rtęci (ii). Leiem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons.
Tlenek rtęci (ii). Leiem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons. W roztworze wodnym HG (OH)2 Jest to bardzo krótkie życie pośrednie, ponieważ szybko uwalnia cząsteczkę wody i wytrąca stałe hgo.
Chociaż nie było możliwe wytrącanie HG (OH) rtęciowego wodorotlenku rtęciowego (OH)2, Tlenek rtęci (ii) HGO jest czymś rozpuszczalnym w wodzie tworząc roztwór gatunków zwanych „wodorotlenkami”.
Te gatunki w wodzie zwanych „wodorotlenkami” są słabymi zasadami i chociaż czasami zachowują się jak amfotoraty, ogólnie HG (OH)2 Jest bardziej podstawowy niż kwas.
Kiedy HGO rozpuszcza się w HCLO4 Badania wskazują obecność jonu rtęciowego Hg2+, Jon monohydroximercoxuro hgoh+ i HG (OH) wodorotlenek rtęciowy2.
Równowagi występujące w takich wodnych roztworach są następujące:
Hg2+ + H2Lub ⇔ HGOH+ + H+
HGOH+ + H2Lub ⇔ Hg (OH)2 + H+
W roztworach alkalicznych Naoh powstaje gatunek HG (OH)3-.
Uzyskanie
Czysty wodorotlenek rtęci
Wodorotlenek rtęci (ii) Hg (OH)2 Nie można go uzyskać w roztworze wodnym, ponieważ dodając alkalia do roztworu jonów handlowych HG2+, wytrąć żółty tlenek rtęciowy.
Jednak niektórym badaczom udało się uzyskać w 2005 r. Po raz pierwszy HG (OH) wodorotlenek rtęciowy2 za pomocą lampy łukowej rtęci, zaczynając od rtęciowego elementu HG, wodoru H2 i tlen lub2.
 Lampa rtęci. D-Kuru [CC BY-SA 2.0 at (https: // creativeCommons.ORG/Licencje/BY-SA/2.0/at/czyn.W)]. Źródło: Wikipedia Commons.
Lampa rtęci. D-Kuru [CC BY-SA 2.0 at (https: // creativeCommons.ORG/Licencje/BY-SA/2.0/at/czyn.W)]. Źródło: Wikipedia Commons. Reakcja jest fotochemiczna i została przeprowadzona w obecności neonu, argonu lub stałego deuteru w bardzo niskich temperaturach (około 5 k = 5 stopni Kelvin). Dowody tworzenia związku uzyskano za pomocą widm absorpcyjnych światła IR (podczerwień).
Może ci służyć: wytrąćHG (OH)2 przygotowany w ten sposób jest bardzo stabilny w warunkach doświadczenia. Szacuje się, że reakcja fotochemiczna przebiega przez pośrednik O-HG-O do stabilnej cząsteczki H-O-HG-O-H.
Koprecypitacja z wodorotlenkiem żelaza (III)
Jeśli siarczan rtęci (ii) HGSO rozpuszcza4 i wiara w siarczan żelaza (iii)2(POŁUDNIOWY ZACHÓD4)3 W kwasowym roztworze wodnym, a pH zaczyna się zwiększać przez dodanie roztworu wodorotlenku sodu NaOH, po czasie odpoczynku, który jest wywierany substancja stała, która jest wywierana przez hgrecipitowana HG (OH)2 i wiara (oh)3.
Stwierdzono, że tworzenie HG (OH)2 Jest to kluczowy krok w tej koprecipitacji z wiarą (OH)3.
Tworzenie HG (OH)2 W wytrąconej wierze (OH)3-HG (OH)2 Zależy to silnie od obecności jonów, takich jak fluor, chlorek lub bromek, od specyficznego stężenia tych i pH roztworu.
W obecności fluoru (F-), PH większy niż 5, koprecitacja HG (OH)2 Z wiarą (OH)3 nie ma to wpływu. Ale do pH 4 tworzenie kompleksów między HG2+ i f- zakłóca się w hoprecipitacji HG (OH)2.
W przypadku obecności chlorku (Cl-), Coprecipitation of Hg (OH)2 Występuje do pH 7 lub więcej, to znaczy, najlepiej w pożywce alkalicznej.
Kiedy bromek jest obecny (BR-), Coprecipitation of Hg (OH)2 Pojawia się przy jeszcze większym pH, to znaczy pH powyżej 8,5 lub więcej alkalicznym niż w przypadku chlorku.
Aplikacje
Z przeglądu dostępnych źródeł informacji wynika, że wodorotlenek rtęci (ii) HG (OH)2, Jako związek, który nie jest jeszcze przygotowany na rynku, nie ma znanych zastosowań.
Ostatnie badania
Za pomocą technik symulacji obliczeniowej w 2013 r2 W stanie gazowym.
Koordynacja i energie solwatacji metal-ligando obliczono i porównano poprzez zmianę stopnia hydratyzacji Hg (OH)2.
Stwierdzono między innymi, że najwyraźniej teoretyczny stan utleniania wynosi 1+ zamiast rzekomego 2+ zwykle przypisywanego do HG (OH)2.
Może ci służyć: wydajność teoretycznaRyzyko
Chociaż HG (OH)2 Jako takie nie było izolowane w wystarczającej ilości.
Może być toksyczny dla układu nerwowego, układu trawiennego, skóry, oczu, układu oddechowego i nerek.
Wdychanie, spożycie lub kontakt ze skórą związków rtęci może powodować uszkodzenia od podrażnienia oczu i skóry, bezsenności, bólu głowy, drżenia, uszkodzenia przewodu pokarmowego, utraty pamięci, niewydolności nerek, między innymi objawami.
Merkury został uznany na arenie międzynarodowej jako zanieczyszczenie. Większość związków rtęciowych, które mają kontakt z środowiskiem, jest metylowana przez bakterie obecne w glebach i osadach, tworząc metylęcior.
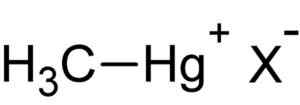 Metherylarmirury Hal. Autor: Przesłane przez użytkownika: Rifleman 82. Źródło: nieznane. Źródło: Wikipedia Commons.
Metherylarmirury Hal. Autor: Przesłane przez użytkownika: Rifleman 82. Źródło: nieznane. Źródło: Wikipedia Commons. Ten związek jest bioakumula w żywych organizmach, przechodzący z ziemi do roślin, a stamtąd do zwierząt. W środowisku wodnym transfer jest jeszcze szybszy, przechodząc z bardzo małych gatunków do dużych w krótkim czasie.
Metherkury ma toksyczny wpływ na żywe istoty, a zwłaszcza dla ludzi.
Kiedy spożywane z jedzeniem jest szczególnie szkodliwe dla małych dzieci i płodów u kobiet w ciąży, ponieważ bycie neurotoksyną może powodować uszkodzenie mózgu i układ nerwowy w tworzeniu.
Bibliografia
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Wang, Xuefeng i Andrews, Lester (2005). Widmo HG (OH) w podczerwieni2 w solidnym neonie i argonie. Nieorganiczna chemia, 2005, 44, 108-113. Odzyskane z pubów.ACS.org.
- Amaro-Estrada, J.Siema., i in. (2013). Wodne solvation HG (OH)2: Badania teorii funkcjonalnej gęstości energetycznej i dynamicznej HG (OH)2-(H2ALBO)N (N = 1-24) Struktury. J. Phys. Chem. Do 2013, 117, 9069-9075. Odzyskane z pubów.ACS.org.
- Inoue, Yoshikazu i Munemori, Makoto. (1979). Koprecipitowanie rtęci (II) z żelazem (III) wodorotlenkiem. Nauk o środowisku i technologii. Tom 13, numer 4, kwiecień 1979. Odzyskane z pubów.ACS.org.
- Chang, L.W., i in. (2010). Układ nerwowy i toksykologia behawioralna. W zrozumieniu toksykologii. Odzyskane z naukowym.com.
- Haney, Alan i Lipsey, Richard L. (1973). Akumulacja i skutki wodorotlenku rtęci metylowego w lądowym łańcuchu pokarmowym w ramach laboratoryjnych warunków. Środowisko. Zanieczyszczenie. (5) (1973) PP. 305-316. Odzyskane z naukowym.com.
- « Charakterystyka dinukleotydu flawina adenin (FAD), biosynteza
- Struktura 3-fosforanu gliceraldehydu (G3P), funkcje »

