Struktura 3-fosforanu gliceraldehydu (G3P), funkcje
- 3848
- 1098
- Filip Augustyn
On 3-fosforan gliceraldehydu (szczelina) Jest to metabolit glikolizy (jego nazwa pochodzi od greckiego; glikos = słodki lub cukier; lizowanie = pęknięcie), który jest szlakiem metabolicznym, który przekształca cząsteczkę glukozy w dwie cząsteczki pirogronianu w celu wytworzenia energii w postaci tryfosforanu adenoziny (ATP (ATP (ATP (ATP ).
W komórkach 3-fosforan gliceraldehydu łączy glikolizę z glukoneogenezą i ścieżką fosforanu pentozowego. W organizmach fotosyntetycznych 3-fosforan gliceraldehydu z ustalania dwutlenku węgla jest wykorzystywany do biosyntezy cukru. W wątrobie metabolizm fruktozy wytwarza lukę, która jest włączona do glikolizy.
 Źródło: Benjah-BMM27 [domena publiczna]
Źródło: Benjah-BMM27 [domena publiczna] [TOC]
Struktura
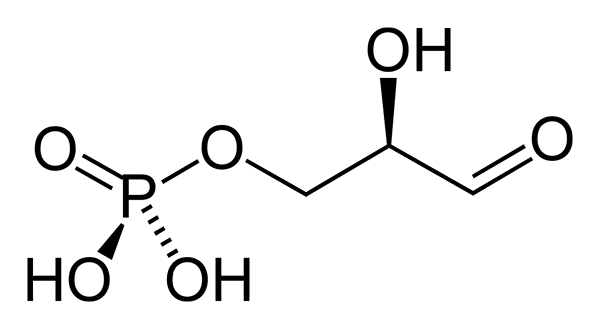
3-fosforan gliceraldehydu to fosforylowany cukier, który ma trzy węgle. Jego empiryczna formuła to c3H7ALBO6P. Grupa aldehydowa (-cho) to węgiel 1 (C-1), grupa hydroksymetylenowa (-CHAH) to węgiel 2 (C-2), a grupa hydroksymetylowa (-ch2OH) to węgiel 3 (C3). Ten ostatni stanowi związek z grupą fosforanową (Fosfoester Link).
3-fosforanowa konfiguracja gliceraldehydu w C-2 Quiral wynosi D. Według konwencji, w odniesieniu do węgla quiralnego, w projekcji fischer grupa aldehydu jest reprezentowana w górę, grupa hydroksymetylo-fosforanu w dół, grupa hydroksylowa po prawej stronie i atom wodoru po lewej.
Charakterystyka
3-fosforan gliceraldehyd ma masę cząsteczkową 170,06 g/mol. Standardowa zmiana energii swobodnej GIBBS (GGº) dla dowolnej reakcji należy obliczyć poprzez dodanie zmiany energii swobodnej produktów i odejmowanie suma zmienności energii swobodnej reagentów.
Może ci służyć: Metazoa: Charakterystyka, typy, siedliska i chorobyW ten sposób określono zmienność energii swobodnej (GGº) z fosforanu gliceraldehydu 3, który wynosi -1,285 kJ × mol-1. Według konwencji, w stanie standardowym 25 ° C i 1 atm, swobodna energia czystych elementów wynosi zero.
Funkcje
Glikoliza i glukoneogeneza
Glikoliza występuje we wszystkich komórkach. Jest on podzielony na dwie fazy: 1) etap inwestycji energetyczny i synteza metabolitów o wysokim potencjale przenoszenia grupy fosforanowej, takim jak 3-fosforan gliceraldehydu (GAP); 2) Stopień syntezy ATP z cząsteczek o wysokim potencjale przenoszenia grupy fosforanowej.
3-fosforan gliceraldehyd i fosforan dihydroksyacetonu. 3-fosforan gliceraldehydu jest przekształcany w 1,3-bifosfoglicenit (1,3BPG), za pomocą reakcji katalizowanej przez dehydrogenazę szczelin enzymatycznych.
Szczelina dehydrogenazy katalizuje utlenianie atomu węgla aldehydowego i przenosi grupę fosforanową. Zatem powstaje mieszany bezwodnik (1,3BPG), w którym grupa kwasowa i atom fosforu są podatne na reakcję ataku nukleofilowego.
Następnie, w reakcji katalizowanej przez kinazę 3-fosfoglicenitową, 1,3BPG przenosi grupę fosforanową z węgla 1 do ADP, tworząc ATP.
Ponieważ reakcje katalizowane przez aldolazę, szczelina dehydrogenazy i kinaza 3-fosfoglicenitowa znajdują się w równowadze (GGº ~ 0), są odwracalne, a zatem część ścieżki glukoneogenezy (lub nowej syntezy glukozy).
Vía de la Pentosa Fosforan i Calvin Cycle
Na drogi fosforanowej pentozowej 3-fosforan (GAP) gliceraldehyd i 6-fosforanowa fruktoza (F6p) powstają przez reakcje cięcia i tworzenia wiązań C-C, z pentozy, ksylulozy 5-fosforanu i rybozy 5-fosforanu 5-fosforanowego.
Może ci służyć: hyracotherium: cechy, odżywianie, gatunki, reprodukcja3-fosforan gliceraldehyd może podążać ścieżką glukoneogenezy i tworzyć glukozę 6-fosforanową, która kontynuuje ścieżkę fosforanu pentozowego. Glukozę można całkowicie utlenić, wytwarzając sześć cO -molekułów2 Przez etap oksydacyjny drogi fosforanowej Pontosa.
W cyklu Calvina, co2 Jest ustawiony jako 3-fosfoglicenit, w reakcji katalizowanej przez rybulową karboksylazę bifosforanową. Następnie 3-fosfoglicenian jest zmniejszony przez NADH przez działanie enzymu zwanego dehydrogenazą GAP.
Potrzebne są cząsteczki GAP do biosyntezy heksozy, takie jak glukoza, która służy biosyntezie skrobi lub celulozy w roślinach w roślinach.
Metabolizm fruktozy
Enzym fruktochinazy katalizuje fosforylację fruktozy przez ATP w C-1, tworząc fruktozę 1-fosforanową. Aldolaza A, która znajduje się w mięśniu, jest specyficzna dla fruktozy 1,6-bifosforanu jako substratu. Aldolaza B występuje w wątrobie i jest specyficzna dla fruktozy 1-fosforanu jako substratu.
Aldolaza B katalizuje pęknięcie aldolickie fosforanu fruktozy i wytwarza fosforan dihydroksyacetonu i gliceraldehyd. Kinaza gliceraldehydu katalizuje fosforylację gliceraldehydu przez ATP, tworząc glikolityczny pośrednik, 3-fosforan gliceraldehydu (GAP).
Na innej drodze gliceraldehyd jest przekształcany w glicerol przez dehydrogenazę alkoholową, której NADH używa jako substrat dawcy elektronów. Następnie kinaza fosforylanowa glicerolu glicerol przez ATP, tworząc fosforan glicerolu. Ten ostatni metabolit to reoxy, tworzący fosforan dihydroksyacetonu (DHAP) i NADH.
DHAP jest przekształcany w szczelinę przez enzym fosforanowy trzy izomease. W ten sposób fruktoza jest przekształcana w metabolity glikolizy. Jednak fruktoza dostarczana dożylnie może powodować poważne uszkodzenie, które składają się z drastycznego spadku fosforanu wewnątrzkomórkowego i ATP. Występuje nawet kwasica mlekowa.
Może ci służyć: Chihuahua Flora i Fauna: Wybitne gatunkiUszkodzenie fruktozy wynika z faktu, że nie ma punktów regulacji, jakie normalnie ma katabolizm glukozy. Po pierwsze, fruktoza wchodzi do mięśni przez Glut5, który jest niezależny od insuliny.
Po drugie, fruktoza jest bezpośrednio przekształcana w szczelinę i w ten sposób nie przechodzi przez regulację enzymu kinazy fosfofuto (PFK) na początku glikolizy.
Przez Entner-Doudoroff
Glikoliza jest uniwersalną drogą katabolizmu glukozy. Jednak niektóre bakterie na przemian używają Entner-Doudoroff Road. Ta trasa implikuje sześć kroków katalizowanych przez enzymy, w których glukoza jest przekształcana w szczelinę i piruvato, które są dwoma końcowymi produktami tej drogi.
Gap i pirogronian są przekształcane w etanol przez alkoholowe reakcje fermentacji.
Bibliografia
- Berg, J. M., Tymoczco, J. L., Stryer, L. 2015. Biochemia. Na krótki kurs. W. H. Freeman, Nowy Jork.
- Miesfeld, r. L., McEvoy, m. M. 2017. Biochemia. W. W. Norton, Nowy Jork.
- Nelson, zm. L., Cox, m. M. 2017. Zasady biochemii lehninger. W. H. Freeman, Nowy Jork.
- Saway J. G. 2004. Metabolizm na pierwszy rzut oka. Blackwell, Malden.
- Voet, d., Voet, J. G., Pratt, c. W. 2008. Podstawy biochemii: życie na poziomie molekularnym. Wiley, Hoboken.
- « Struktura wodorotlenku rtęci, właściwości, zastosowania, ryzyko
- Charakterystyka i tworzenie warstw »

