Struktura hydrolazazy, funkcje, przykłady

- 4696
- 1350
- Herbert Wróblewski
Hydrolaza Są to enzymy odpowiedzialne za hydrolizowanie różnych rodzajów połączeń chemicznych w wielu różnych związkach. Wśród głównych powiązań, które hydrolizez to estr, glukozydyczne i peptydowe łącza.
W grupie hydrolaz sklasyfikowano ponad 200 różnych enzymów, zgrupowanych co najmniej 13 indywidualnych zestawów; Jego klasyfikacja jest zasadniczo oparta na rodzaju związku chemicznego, który służy jako podłoże.
 Modelowanie graficzne z narzędziami bioinformatyki struktury hydrolazy (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) za pośrednictwem Wikimedia Commons)
Modelowanie graficzne z narzędziami bioinformatyki struktury hydrolazy (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [domena publiczna] za pośrednictwem Wikimedia Commons) za pośrednictwem Wikimedia Commons) Hydrolazy są niezbędne do trawienia pokarmu w jelicie zwierząt, ponieważ są odpowiedzialne za degradowanie dużej części połączeń, które składają się na gazowane struktury spożywanych przez nich żywności.
Te enzymy działają w pożywce wodnej, ponieważ potrzebują wokół nich cząsteczek wody, aby dodać do związków, gdy cząsteczki zostaną podzielone. Krótko mówiąc, hydrolazy wykonują hydrolityczną katalizę związków, na których działają.
Na przykład, gdy hydrolaza łamie wiązanie kowalencyjne C-C, wynikiem jest zwykle grupa C-O i grupa C-H.
[TOC]
Struktura
Podobnie jak wiele enzymów, hydrolazy są zorganizowane białka kuliste w złożonych strukturach, które są organizowane przez interakcje wewnątrzcząsteczkowe.
Hydrolazy, podobnie jak wszystkie enzymy, wiążą się z jedną lub większą liczbą cząsteczek substratu w obszarze jego struktury znanej jako „miejsce aktywne”. To miejsce jest kieszenią lub rozszczepem otoczonym wieloma resztami aminokwasowymi, które ułatwiają uchwyt lub połączenie podłoża.
Każdy rodzaj hydrolazy jest specyficzny dla danego podłoża, który jest określany przez jej trzeciorzędową strukturę i tworzenie aminokwasów, które tworzą ich aktywne miejsce. Ta specyficzność została podniesiona dydaktycznie przez Emil Fischer jako rodzaj „klucza i zamka”.
Może ci służyć: polimeraza: charakterystyka, struktura i funkcjeObecnie wiadomo, że podłoże ogólnie indukuje zmiany lub zniekształcenia w tworzeniu enzymów i że enzymy z kolei zniekształcają strukturę substratu, aby zapewnić, że ta „koronka” w miejscu aktywnym.
Funkcje
Wszystkie hydrolazy mają główną funkcję rozbijania wiązań chemicznych między dwoma związkami lub w strukturze tej samej cząsteczki.
Istnieją hydrolazy, które przełamują prawie każdy rodzaj ogniwa: niektóre degradują wiązania estrowe między węglowodanami, innymi wiązaniami peptydowymi między aminokwasami białkowymi, innymi wiązaniami karboksylowymi itp.
Cel procesu wiązania chemicznego katalizowanego przez enzym hydrolazowy jest znacznie różny. Smozyme na przykład jest odpowiedzialny za hydrolizę wiązań chemicznych z celami ochrony organizmu, które go syntetyzują.
Ten enzym degraduje połączenia, które utrzymują razem ze związkami w ścianie komórkowej bakterii, w celu ochrony ludzkiego ciała przed proliferacją bakterii i możliwą infekcją.
Nucleas to enzymy „fosfatazy”, które mają zdolność degradacji kwasów nukleinowych, które mogą również reprezentować mechanizm obrony komórki przeciwko wirusom DNA lub RNA.
Inne hydrolazy, takie jak typu „proteazy”, degradują wiązania peptydowe białek w przewodzie pokarmowym, aby aminokwasy były asymilacyjne w nabłonku przewodu pokarmowego.
Nawet hydrolazy biorą udział w różnych zdarzeniach produkcji energii w metabolizmie komórkowej, ponieważ fosfatazy katalizują uwalnianie cząsteczek fosforanowych z podłożów wysokiej energii, takich jak pirogronian, w glikolizie.
Może ci służyć: chwyt sojowyPrzykłady hydrolazazy
Wśród wielkiej różnorodności zidentyfikowanej przez naukowców hydrolaz, niektórzy badano z większym naciskiem niż inne, ponieważ są zaangażowani w wiele istotnych procesów życia komórkowego.
Wśród nich są gładkość, seryna proteazy, fosfatazy endonukleus.
Gładkość
Enzymy tego typu pękają. Zwykle powoduje to całkowitą lizę bakterii.
Smozymy bronią ciała zwierząt zakażeń bakteryjnych i są obfite w wydzielania ciała w tkankach, które są w kontakcie ze środowiskiem, na przykład łzy, śliną i śluzem.
Gładkie jajo kurczowe było pierwszą strukturą białka, która krystalizowała przez x -kas. Ta krystalizacja dokonał David Phillips w 1965 roku w London Real Institute.
Aktywne miejsce tego enzymu składa się z asparaginy-alaniny-mechchanicznej peasparaginy-glicyny-glicyny-proagin-pllain-metioniny peptyd (NAM-NAG-NAM).
Protease Serin
Enzymy tej grupy są odpowiedzialne za hydrolizujące wiązania peptydowe w peptydach i białkach. Najczęściej badane to trpsyna i chimotrypsyna; Istnieje jednak wiele różnych rodzajów proteaz, które różnią się w odniesieniu do swoistości podłoża i jego mechanizmu katalizy.
„Proteazy” charakteryzują się posiadaniem nukleofilowego aminokwasu typu serynowego. Proteasas Serin jest również w stanie przełamać szeroką gamę linków estrowych.
Może ci służyć: jaki jest skład chemiczny żywych istot?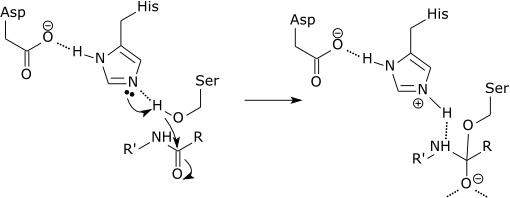 Schemat graficzny działania proteazy, który łamie łącze peptydowe w aminokwasie histydyny (źródło: Zephyris w języku angielskim Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/)] przez Wikimedia Commons)
Schemat graficzny działania proteazy, który łamie łącze peptydowe w aminokwasie histydyny (źródło: Zephyris w języku angielskim Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/)] przez Wikimedia Commons) Te enzymy przecinają peptydy i białka w sposób niespecyficzny. Jednak wszystkie peptydy i białka, które mają być cięte.
Każda krótka proteaza jest dokładnie wiązaniem amida, które powstaje między C-końcowym końcem aminokwasu w końcu karboksylowym a aminą kwasu aminowego, która jest w kierunku N-końcowego końca peptydu.
Fosfatazy nukleazowe
Katalog enzymów. Istnieje wiele różnych rodzajów tych enzymów, ponieważ są one specyficzne dla rodzaju kwasu nukleinowego i miejsca cięcia.
 Schemat graficzny działania endonukleazy hydrolizujący wiązanie fosfodiéster (źródło: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Schemat graficzny działania endonukleazy hydrolizujący wiązanie fosfodiéster (źródło: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Endonukleazy są niezbędne w dziedzinie biotechnologii, ponieważ pozwalają naukowcom modyfikować genomy organizmów poprzez cięcie i zastąpienie fragmentów informacji genetycznej prawie każdej komórki.
Endonukleazy wykonują cięcie azotowych zasad w trzech etapach. Pierwszy dotyczy nukleofilowego aminokwasu, następnie powstaje struktura pośrednia z obciążeniem ujemnym, które przyciąga grupę fosforan.
Bibliografia
- Davies, g., & Henrissat, b. (1995). Struktury i mechanizmy hydroli glikozylowej. Struktura, 3 (9), 853-859.
- Lehninger, a. L., Nelson, zm. L., Cox, m. M., & Cox, m. M. (2005). Zasady biochemii lehninger. Macmillan.
- Mathews, a. P. (1936). Zasady biochemii. W. Drewno.
- Murray, r. K., Granner, zm. K., Mayes, str., & Rodwell, V. (2009). Ilustrowana biochemia Harpera. 28 (str. 588). Nowy Jork: McGraw-Hill.
- Ollis, zm. L., Cheeah, e., Cygler, m., Dijkstra, ur., Folow, f., Franken, s. M.,… & Sussman, j. L. (1992). Fałd hydrolazy α/β. Białko inżynierskie, projektowanie i selekcja, 5 (3), 197-211.

