Grupa hydroksylowa

- 2117
- 446
- Maksymilian Kępa
Wyjaśniamy, czym jest grupa hydroksylowa, jej charakterystyka, struktura i kilka przykładów
 Struktura chemiczna grupy hydroksylowej
Struktura chemiczna grupy hydroksylowej Co to jest grupa hydroksylowa?
A Grupa hydroksylowa Jest to grupa funkcjonalna lub część innych grup funkcjonalnych obecnych w wielu związkach organicznych i nieorganicznych. Powstaje w wyniku atomu wodoru i jednego z tlenu (stąd jego nazwa).
Grupy hydroksylowe są zwykle powiązane z atomem węgla lub innym niemetalicznym pierwiastkiem, takim jak siarka lub fosfor, i są jedną z najważniejszych grup funkcjonalnych w chemii organicznej.
Ta grupa atomów jest obecna w organicznych grupach funkcjonalnych, takich jak alkohole, fenole i kwasy karboksylowe, i jest tą, która daje każdemu z tych grup funkcjonalnych charakterystyk właściwości chemicznych charakterystyki charakterystyki charakterystyki charakterystyki. W różnych strukturach może być reprezentowany jako -OH lub HO-
Charakterystyka grup hydroksylowych
- Składa się z atomu tlenu i jednego z wodoru połączonego ze sobą i połączonym z innym atomem w cząsteczce przez kowalencyjne wiązania.
- Związek między wodorem i atomem tlenu jest wiązaniem polarnym, w którym tlen ma ujemne obciążenie częściowe i dodatnie wodór częściowe, co czyni grupę hydroksylową grupą funkcjonalną polarną A.
- Ma konstrukcję podobną do struktury wody. Z tego powodu wiele zawieranych przez niego związków jest zwykle rozpuszczalnych we wspomnianym rozpuszczalniku.
- Ma wodór bezpośrednio związany z atomem tlenu, więc grupa hydroksylowa może tworzyć wiązanie wodorowe, w którym uczestniczy jako grupa wodorowa dawcy.
- Mając dwa wolne elektrony na atomie tlenu, grupa hydroksylowa może tworzyć dwa dodatkowe wiązania wodorowe działające jako akceptor atomów wodoru.
- Możesz działać jak kwas, nadając protonowi podstawie. W zależności od grupy funkcjonalnej, której jest częścią i atomem, z którym jest bezpośrednio połączony, grupa hydroksylowa może wykazywać różne poziomy kwasowości. Na przykład w alkohole ma PKA 15 lub więcej (zaciekł kwas niż woda), w fenole waha się między 7 a 10, podczas gdy w kwasach karboksylowych zwykle wynosi od 4 do 5.
- Możesz także działać jako baza Lewisa, przekazując jedną z pary elektronów, aby połączyć się z innym protonem lub innym kwasem Lewis.
Struktura grupy hydroksylowej
Jak wspomniano wśród cech, atomy tlenu i wodoru w grupie hydroksylowej tworzą polarne wiązanie kowalencyjne.
Ponadto atom tlenu tworzy drugie wiązanie kowalencyjne z innym atomem, który jest częścią cząsteczki jako alkoholu, fenol z innymi złożonymi. Struktura Lewisa tej grupy przedstawiono poniżej:
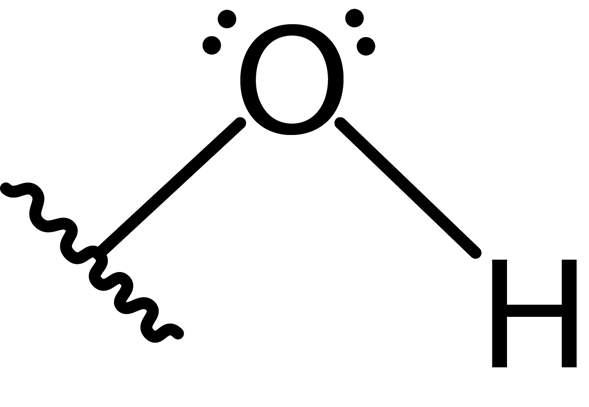
Ze względu na obecność dwóch pary wolnych elektronów na atomie tlenu i dwóch wiązań kowalencyjnych, grupa hydroksylowa ma geometrię kątową o kącie około 104 °, nieco niższym niż kąt czworościenny. Długość wiązania tlenu-hydrogenu wynosi około 0.97 Angstromów.
Grupa hydroksylowa, rodnik hydroksylowy i anion wodorotlenkowy
Bardzo często zdezorientowanie grupy hydroksylowej z rodnikiem hydroksylowym i anionem hydroksydowym, ponieważ wszystkie są tworzone przez te same dwa atomy, jednak terminy te nie odnoszą się do tego samego.
Z jednej strony rodnik hydroksylowy różni się od grupy hydroksylowej, w której jest wolnym rodnikiem z nieparzystą liczbą elektronów walencyjnych, a także nie jest powiązany z żadnym innym atomem lub grupą atomów (dlatego jest to powiedziane bezpłatnie).
Pomimo tych różnic wiele osób błędnie używa terminu rodnika hydroksylowego w odniesieniu do grupy hydroksylowej, gdy jest obecna w cząsteczce.
Z drugiej strony anion wodorotlenkowy jest jonem o obciążeniu ujemnym utworzonym przez wodór i tlen, podczas gdy grupa hydroksylowa jest grupą neutralną.
Ponadto, podczas gdy grupa hydroksylowa jest zawsze powiązana z cząsteczką za pomocą wiązania kowalencyjnego, związki zawierające jony wodorotlenkowe mają wiązanie jonów między tym a niektórymi metalami, takimi jak sód, lit lub potas.
Może ci służyć: jaka jest anoda i katoda?Przykłady grupy hydroksylowej
Alkohole
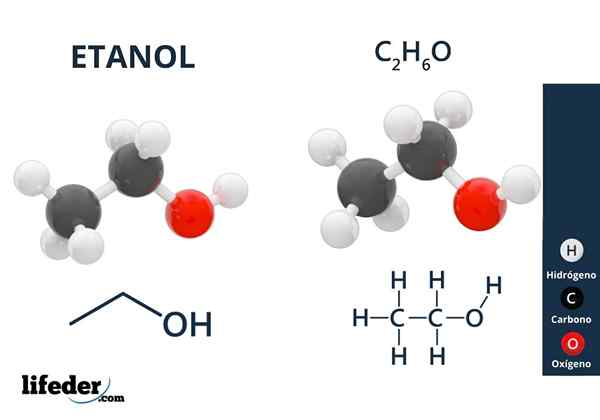 Etanol
Etanol Alkohole mają grupy hydroksylowe powiązane z węglem alifatycznym. Przykładami alkoholi są:
- Alkohol metylowy.
- Etanol.
- Alkohol izopropylowy.
Fenole
Fenole charakteryzują się bezpośrednio połączonym z grupy hydroksylowej. Niektóre przykłady typowych fenoli to:
- Fenol.
- Alfa i beta-naftol.
- Ortho, cel i dla Cresolu.
Węglowodany
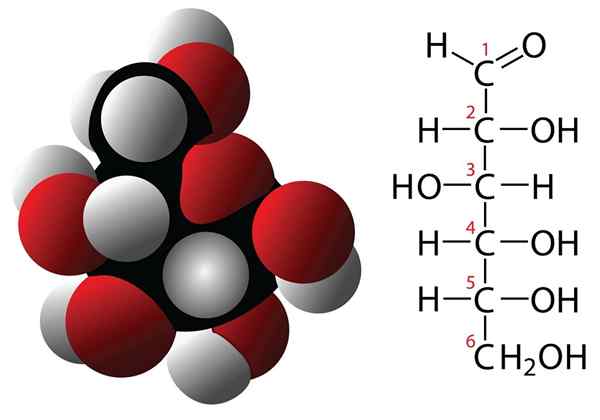 Cząsteczka glukozy i wzoru molekularnego
Cząsteczka glukozy i wzoru molekularnego Węglowodany są związkami z 3 lub więcej atomami węgla, które charakteryzują się formułem empirycznym utworzonym przez węglowodany i cząsteczki wody. Związki te często mają wiele grup wodorotlenowych, co czyni je bardzo rozpuszczalnymi w wodzie. Niektóre przykłady węglowodanów to:
- Glukoza.
- Fruktoza.
- Sacharoza.
Kwasy karboksylowe
Grupa karboksylowa obecna w kwasach karboksylowych odpowiada jednej z najbardziej kwaśnych grup funkcjonalnych, jakie może mieć cząsteczka organiczna. Związki te są zwykle słabymi kwasami podczas porównywania ich z niektórymi kwasami mineralnymi, ale mogą stać się znacznie kwaśne w zależności od ich struktury.
Kwasowość grupy karboksylowej wynika z obecności grupy hydroksylowej połączonej z grupą karbonylową, która stabilizuje ujemne obciążenie anionu, które tworzy się, gdy hydroksyl daje jej proton. Niektóre przykłady kwasów karboksylowych to:
- Kwas octowy.
- Kwas benzoesowy.
- Kwas trifluorooctowy.
Kwasy sulfonowe
Kwasy sulfonowe to związki organiczne, które powstają w wyniku reakcji między niektórymi związkami organicznymi a kwasem siarkowym lub dwutlenkiem siarkowym. Tego rodzaju związki mają grupę hydroksylową i ogólnie są dość silnymi kwasami, porównywalnymi z kwasem siarkowym.
Niektóre przykłady kwasów sulfonowych to:
- Kwas pentosulfonowy.
- Izomery kwasu orto, bramki i toluensulfonu.
- Kwas benzeulfonowy.
Kwasy nieorganiczne
Grupy hydroksylowe nie tylko pojawiają się w związkach organicznych. Posiada je również wiele związków nieorganicznych, w szczególności kwasów oksykowych. W takich przypadkach grupa hydroksylowa jest bezpośrednio powiązana z nie -metalowym, zwykle inną od węgla.
Niektóre przykłady kwasów nieorganicznych, które mają grupy hydroksylowe wraz z nie -metalowym, z którym jest powiązany:
- Kwas hipochlorysty, w którym grupa hydroksylowa jest powiązana z atomem chloru.
- Kwas siarkowy, który ma dwie grupy hydroksylowe związane z atomem siarki.
- Kwas fosforowy, w którym trzy grupy hydroksylowe są powiązane z atomem fosforowym.

