Właściwości gazów, zachowanie, forma, przykłady

- 2316
- 2
- Estera Wojtkowiak
Gazy Są to wszystkie te substancje lub związki, których stany agregacji są słabe i rozproszone, a jednocześnie w zależności od warunków ciśnienia i temperatury, które je rządzą. Być może stanowią drugą formę materii bardziej obfitą w całym wszechświecie po plazmie.
Na Ziemi gazy tworzą warstwy atmosfery, od egzosformy, do troposfery i powietrza, które oddychamy. Chociaż gaz jest niewidoczny, gdy jest rozpowszechniany przez duże przestrzenie, takie jak niebo, jest wykrywany przez ruch chmur, zakręty łopat młyna lub przez wydychane opary naszych ust w zimnych klimatach.
 Gazy można obserwować w kominach przemysłowych lub domowych, a także w wieżach dymnych emanujących przez wulkany. Źródło: Pxhere.
Gazy można obserwować w kominach przemysłowych lub domowych, a także w wieżach dymnych emanujących przez wulkany. Źródło: Pxhere. Podobnie, przechodząc do negatywnych aspektów środowiskowych, obserwuje się go w czarnym dymie rury wydechowej pojazdów, w kolumnach dymu wież znajdujących się w fabrykach lub w dymie uniesionym, gdy las pali.
W obliczu zjawisk gazowych jest również w obliczu zjawisk gazowych, gdy widać opary, które opuszczają kanały, w fatalnych pożarach bagna i cmentarzy, w tlenu bubb uwalnianym przez produkt roślin ich fotosyntezy, a nawet w erutach i wzdęciu.
Gdziekolwiek są obserwowane gazy, oznacza to, że nastąpiła reakcja chemiczna, chyba że są one ustalone lub zasymilowane bezpośrednio z powietrza, główne źródło gazów (powierzchownie) planety. Wraz ze wzrostem temperatury każda substancja (pierwiastki chemiczne) zostaną przekształcone w gazy, w tym metale, takie jak żelazo, złoto i srebro.
Niezależnie od chemicznego charakteru gazów, wszyscy dzielą wspólny odległość, która oddziela ich cząstki (atomy, cząsteczki, jony itp.), które poruszają się chaotycznie i arbitralnie przez określoną objętość lub przestrzeń.
[TOC]
Właściwości gazu
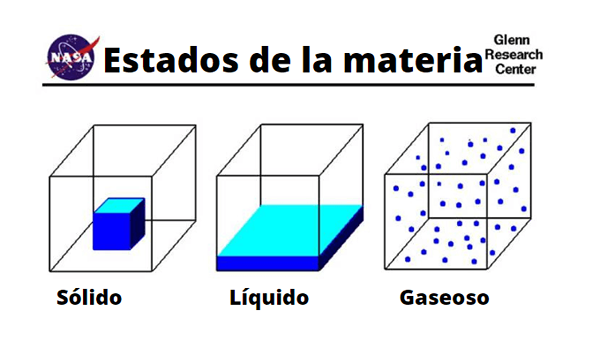 Różnice w cząsteczkach stałych, cieczy i gazowej
Różnice w cząsteczkach stałych, cieczy i gazowej Fizyczny
Fizyczne właściwości gazów różnią się w zależności od tego, czym jest substancja lub związek. Popularnie gazy są związane ze złymi zapachami lub zgnilizną ze względu na zawartość siarki lub obecność lotnych amin. Podobnie są wizualizowane przez zielone, brązowe lub żółtawe zabarwienie, które zastraszają i dają zły omen.
Jednak większość gazów, a przynajmniej najbardziej obfita, jest w rzeczywistości bezbarwna i bezwonna. Nawet jeśli nie są one niezaranymi, mogą być odczuwalne na skórze i przeciwstawić się odporności na ruch, nawet tworząc lepkie warstwy w ciałach, które je przekraczają (jak w przypadku samolotów).
Wszystkie gazy mogą doświadczać zmian ciśnienia lub temperatury, które ostatecznie wytwarzają odpowiednie ciecze; to znaczy cierpią z kondensacji (jeśli są ochłodzone) lub upłynnienie (jeśli są „naciśnięte”).
 Kondensacja; stanu gazowego do stanu ciekłego
Kondensacja; stanu gazowego do stanu ciekłego Z drugiej strony gazy są zdolne do rozpuszczenia w cieczach i niektórych porowatych ciał (takich jak węgiel aktywny). Pęcherzyki są wynikiem klastrów gazowych, które jeszcze nie rozpuściły się na środku i nie uciekają na powierzchnię cieczy.
Przewodność elektryczna i termiczna
W normalnych warunkach (bez jonizacji ich cząstek) gazy są złymi czynnikami cieplnymi i elektrycznymi. Jednak gdy są napięte z wieloma elektronami, pozwalają na przejście prądu przez nich, jak widać na promieniach podczas burz.
Z drugiej strony, przy niskich ciśnieniach i poddanych polu elektrycznego, niektóre gazy, zwłaszcza szlachetne lub idealne, oświetlone i ich światła są używane do projektowania życia nocnego i plakatów (neonowe światło), a także w słynnym porażeniu elektrycznym lampy na latarniach ulicznych.
Może ci służyć: Granataria Bilans: Charakterystyka, części i jak z niego korzystaćJeśli chodzi o przewodność cieplną, wiele gazów zachowuje się jak izolatory termiczne, tak że ich włączenie do wypełnienia włókien, tkanek lub paneli szklanych pomaga zapobiegać parzeniu ciepła i utrzymanie stałej temperatury.
Istnieją jednak gazy, które są dobrymi przewodnikami cieplnymi i mogą powodować gorsze oparzenia spowodowane cieczami lub ciałami stałymi; Na przykład, podobnie jak w przypadku gorącej pary pieczonych ciast (lub empanadas) lub z dyszami parowymi, które uciekają z kotłów.
Reaktywność
Zasadniczo reakcje obejmujące gazy lub tam, gdzie występują, są opisywane jako niebezpieczne i uciążliwe.
Jego reaktywność zależy ponownie od ich chemicznego charakteru; Jednak podczas znacznie rozszerzania się i mobilizacji należy podjąć większą ostrożność i kontrolę, ponieważ mogą one wywołać drastyczne wzrosty ciśnienia, które narażają strukturę reaktora; Nie wspominając o tym, jak łatwopalne lub nie są szczęśliwymi gazami.
Zachowanie Gase
Makroskopowo można podać wyobrażenie o zachowaniu gazów, świadkiem, jak dym, pierścienie lub literackie „języki” papierosów ewoluują w powietrzu. Ponadto, gdy wybucha granat dymu, interesujące jest szczegółowe opisanie ruchu tych chmur w różnych kolorach.

Jednak takie obserwacje podlegają działaniu powietrza, a także faktowi, że są bardzo drobne stałe cząstki zawieszone w dymie. Dlatego te przykłady nie wystarczą, aby dojść do wniosku dotyczącego prawdziwego zachowania gazu. Zamiast tego przeprowadzono eksperymenty i opracowano kinetyczną teorię gazów.
Molekularne i najlepiej, cząsteczki gazowe elastycznie zderzają się ze sobą, mając przemieszczenia liniowe, obrotowe i wibracyjne. Mają średnią powiązaną energię, która pozwala jej swobodnie podróżować przez dowolną przestrzeń bez prawie interakcji lub zderzenia z inną cząsteczką, gdy objętość wzrasta wokół nich.
Jego zachowanie byłoby mieszanką nieregularnego ruchu Browna i zderzenia piłek bilardowych, które odbijają się nieustannie i ściany stołu; Jeśli nie ma ścian, rozprzestrzenią się w kierunku nieskończoności, chyba że ich zachowają: grawitacja.
Gaza
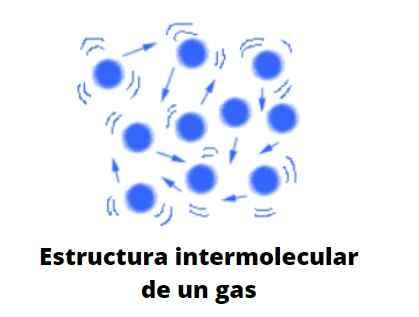
Gazy, w przeciwieństwie do cieczy i ciał stałych, nie podlegają kondensowanym typowi; to znaczy agregacja lub spójność ich cząstek nigdy nie udało się zdefiniować formy. Dzielą się z płynami fakt, że całkowicie zajmują objętość pojemnika, który je zawiera; Jednak brakuje im napięcia powierzchniowego i powierzchniowego.
Jeśli stężenie gazu jest wysokie, opisane już „języki” lub makroskopowe formy można wizualizować nagim okiem. Te, prędzej czy później, skończą się zanikać z powodu działania wiatru lub samej ekspansji gazu. Dlatego gazy obejmują wszystkie zakątki ograniczonej przestrzeni, powodując wysoce jednorodne systemy.
Teraz teoria wygodnie uważa gazy za kulki, które ledwo się ze sobą zderzają; Ale kiedy to robią, podskakują elastycznie.
Sfery te są bardzo oddzielone od siebie, więc gazy są praktycznie „pełne” próżni; Stamtąd jesteś winien swoją wszechstronność, aby przekroczyć najmniejszą szczelinę lub szczelinę, a także łatwość bycia w stanie ich kompresować.
Może ci służyć: tlenki nie -metaloweDlatego jednak zamknęło instalację piekarni, jeśli chodzenie z boku jest pewne, że zapach świeżo upieczonego chleba będzie się cieszył.
Ciśnienie gazu
Można wierzyć, że poprzez tak rozproszone i oddzielone kulki gazowe lub cząstki, nie są one w stanie wygenerować żadnego ciśnienia na ciałach lub przedmiotach. Jednak atmosfera pokazuje, że takie przekonanie jest fałszywe: ma masę, waży i zapobiega odparowaniu lub gotowaniu płynów. Punkty wrzenia są mierzone pod ciśnieniem atmosferycznym.
Naciski na gazę stają się bardziej wymierne, jeśli dostępne są manometry lub jeśli są zamknięte z nieokformacyjnych pojemników ściennych. Zatem im więcej cząstek gazu jest wewnątrz pojemnika, tym większa liczba zderzeń między nimi a ścianami tego samego.
Cząstki te podczas zderzenia z ścianami naciskają je, gdy wywierają na powierzchnię siłę proporcjonalną do energii kinetycznej. To tak, jakby idealne kulki bilardowe do ściany były przytłoczone; Jeśli jest wiele, które wpływają na nich z dużą prędkością, może to się przerwać.
Jednostki
Istnieje wiele jednostek, które towarzyszą pomiarom ciśnienia gazu. Niektóre z najbardziej znanych to milimetry rtęci (MMHG), a także Torr. Są systemami międzynarodowego systemu jednostek (SI), które definiują Pascal (PA) pod względem N/M2; I jego, Kilo (KPA), Mega (MPA) i Giga (GPA) Pascal.
Objętość gazu
Gaz zajmuje i rozszerza się w całej objętości pojemnika. Im większy pojemnik będzie również objętość gazu; Ale zarówno ich ciśnienie, jak i gęstość spadną dla tej samej ilości cząstek.
Z drugiej strony sam gaz ma powiązaną objętość, która nie zależy tyle od jego natury lub struktury molekularnej (najlepiej), ale od regulacji ciśnienia i temperatury; To jest jego objętość molowa.
W rzeczywistości objętość molowa zmienia się w zależności od gazu, chociaż zmiany są małe, jeśli nie są z heterogenicznych i dużych cząsteczek. Na przykład objętość molowa amoniaku (NH3, 22 079 l/mol) w 0 ° C i 1 atm różni się od helu (HE, 22 435 l/mol).
Wszystkie gazy mają objętość molową, która zmienia się w zależności od P i T, i niezależnie od tego, jak duże są ich cząsteczki, ich liczba jest zawsze taka sama. Stąd wyprowadził to, co jest znane pod numerem Avogadro (nDO).
Główne prawa gazów
Zachowanie GASE badano od minionych stuleci poprzez eksperymenty, głębokie obserwacje i interpretację wyników.
Takie eksperymenty pozwoliły na szereg praw, które zebrały się w tym samym równaniu (odpowiedzi idealnych), pomóc przewidywać reakcje gazu na różne warunki ciśnienia i temperatury. W ten sposób istnieje związek między jego objętością, temperaturą i ciśnieniem, a także liczbą ich moli w określonym układzie.
Wśród tych praw są następujące cztery: Boyle, Charles, Gay-Lussac i Avogadro.
Boyle Law
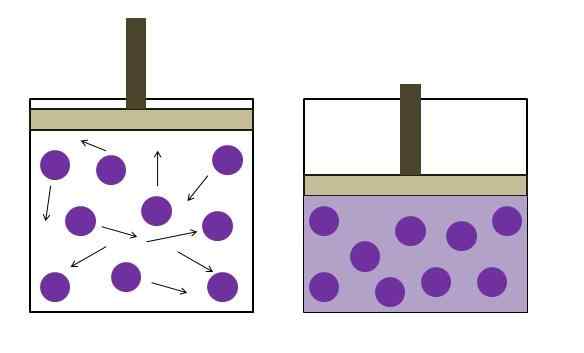 Zwiększone ciśnienie redukcji ciśnienia. Źródło: Gabriel Bolívar
Zwiększone ciśnienie redukcji ciśnienia. Źródło: Gabriel Bolívar Prawo Boyle'a stwierdza, że w stałej temperaturze objętość idealnego gazu jest odwrotnie proporcjonalna do jego ciśnienia; To jest, im większy pojemnik, tym niższe ciśnienie, jakie będą doświadczać jego ściany według tej samej ilości gazu.
Może ci służyć: Charles Law: Formule i jednostki, eksperyment, ćwiczeniaCharles Law
 Chińskie latarnie lub życzenia. Źródło: Pxhere.
Chińskie latarnie lub życzenia. Źródło: Pxhere. Prawo Karola określa, że przy stałym ciśnieniu objętość gazu idealnego jest wprost proporcjonalna do jego temperatury. Balony pokazują Charlesa.
Prawo gej-leussac
Prawo Gay-Lussac stwierdza, że przy stałej objętości ciśnienie gazu idealnego jest wprost proporcjonalne do jego temperatury. W dobrze zamkniętym kotle, jeśli gaz stopniowo się ogrzewa, za każdym razem, gdy ciśnienie w środku będzie większe, ponieważ ściany kotła nie są deformowane ani rozszerzone; To znaczy, jego objętość się nie zmienia, jest stała.
Prawo Avogadro
Wreszcie, prawo Avogadro określa, że objętość zajmowana przez gaz idealny jest bezpośrednio proporcjonalny do liczby jego cząstek. Jest to zatem, jeśli masz mol cząstek (6,02,1023), wówczas objętość molowa gazu będzie.
Rodzaje gazów
Gazy palne
Są to gazy, których komponenty działają jako paliwa, ponieważ są one wykorzystywane do produkcji energii cieplnej. Niektóre z nich to gaz ziemny, olej skroplony i wodorowy.
Gazy przemysłowe
Są to produkowane gazy, które są sprzedawane publicznie do różnych zastosowań i zastosowań, takich jak sektory zdrowia, żywność, ochrona środowiska, metalurgia, przemysł chemiczny, bezpieczeństwo,. Niektóre z tych gazów to tlen, azot, hel, chlor, wodór, tlenek węgla, propan, metan, podtlenek azotu.
Gazy obojętne
Są to gazy, które w określonych warunkach temperatury i ciśnienia nie generują żadnej reakcji chemicznej lub bardzo niskiej. Są neonem, argonem, helem, kriptonem i ksenonem. Są one stosowane w procesach chemicznych, w których konieczne są elementy niereaktywne.
Przykłady elementów i związków gazowych
Jakie są gazowe elementy stolika okresowego w warunkach naziemnych?
Najpierw mamy wodór (H), który tworzy cząsteczki H2. Następnie następuje hel (on), lżejszy szlachetny gaz; a następnie azot (N), tlen (O) i fluorek (F). Te ostatnie trzy ostatnie tworzą cząsteczki dwuatomiczne: n2, ALBO2 i f2.
Po fluorku pojawia się neon (NE), szlachetny gaz, który podąża za helem. Pod fluorem mamy chlor (CL), w postaci cząsteczek CL2.
Następnie mamy resztę gazów szlachetnych: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) i Oganeson (OG).
Dlatego są to w sumie dwanaście elementów gazowych; Jedenaście, jeśli wykluczymy wysoce radioaktywny i niestabilny oganezon.
Związki gazowe
Oprócz elementów gazowych wymienione zostaną niektóre wspólne związki gazowe:
-H2S, siarkowodór, odpowiedzialny za zapach zgniłych jaj
-NH3, amoniak, ten penetrujący aromat postrzegany w używanych mydłach
-WSPÓŁ2, Dwutlenek węgla, gaz cieplarniany
-NIE2, dwutlenek azotu
-Nie, tlenek azotu, gaz, który był uważany za wyjątkowo toksyczny, ale odgrywa ważną rolę w układzie krążenia
-południowy zachód3, TRIOTOLENSIDE SUARKI
-C4H10, butan
-HCl, chlorek wodoru
-ALBO3, ozon
-SF6, Hexafluoruro siarki
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Właściwości gazów. Źródło: chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Gaz. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (5 grudnia 2018 r.). Gazy - ogólne właściwości gazów. Odzyskane z: Thoughtco.com
- Harvard Men's Health Watch. (2019). Stan gazu. Odzyskane z: zdrowie.Harvard.Edu
- Redaktorzy chłodnicze elektroniki. (1 września 1998). Przewodność cieplna gazów. Odzyskane z: chłodzenie elektroniki.com
- « Historia demonologii, jakie studia i znani demonologowie
- Nowe cechy graficzne, elementy, przykłady »

