Struktura fulminacji rtęci, właściwości, uzyskiwanie, zastosowania
- 3133
- 203
- Gabriela Łuczak
On Merkury Fulmate Jest to związek nieorganiczny utworzony przez rtęć (Hg), węgiel (C), azot (N) i tlen (O) piersi (O). Jego wzór chemiczny to HG (CNO)2. Nie należy go mylić z cyjanato rtęci, ponieważ chociaż oba związki mają te same pierwiastki, w tych ostatnich atomy wiążą się inaczej.
Został odkryty przez angielskiego chemika Edwarda Howarda w 1800 roku. Jednak prawie 200 lat przed przypadkowo zsyntetyzowanym przez niemieckiego alchemika Johannesa Kunckela, który z powodu eksplozji go nie izolował, ale pozostawił pisemne zapisy używanych składników.
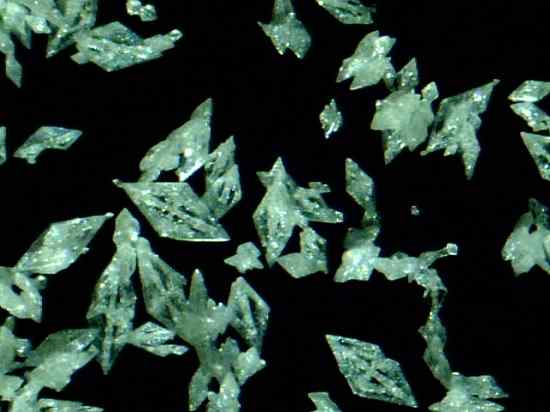
 Mercury Fulminat Crystals HG (CNO)2. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Mercury Fulminat Crystals HG (CNO)2. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Jest podstawowym wybuchem, więc jest stosowany w zakładzie perkusyjnym lub wybuchowym w celu promowania eksplozji innych substancji. Chociaż jego przygotowanie i ochrona jest wyjątkowo niebezpieczne, był szeroko stosowany w dziewiętnastym wieku jako detonator w wojnie i broni polowaniu.
Obecnie jest używany do detonacji potężnych obciążeń dynamitu w budowie tuneli i dróg i wydobycia.
Jest to wyraźnie niezwykle niebezpieczny związek, który może być manipulowany tylko przez osoby z głęboką wiedzą na temat radzenia sobie z materiałami wybuchowymi.
[TOC]
Struktura
HG (CNO)2 Jest to sól fulminowa hcno sól fulminową. Zawiera rtęć w utlenianiu +2 i dwóch jednostkach fulminacyjnych CNO-.
Zgodnie z badaniem rentgenowskim przeprowadzonym w 2007 r. W Niemczech (zgłoszonych w języku angielskim w 2008 r.), Cząsteczki fulminacji rtęci mają strukturę ONC-HG-CNO, gdzie obserwuje się, że rtęć jest bezpośrednio związana z atomami węgla.
Związek C-HG-C jest liniowy; tworzy kąt 180 °, a grupa fulminat (CNO) ma krótkie wiązanie węglowe azotu i dłuższe wiązanie azotu-tlenu.
Długość łącza C-N wynosi 1,14-1,17 Å (Angstroms), co odpowiada potrójnego słabego łącza. Link N-O wynosi 1,20-1,25 Å, który wskazuje słabe podwójne wiązanie. Angstrom (Å) jest miarą długości i jest częścią dziesięciu mierników.
Może ci służyć: metody rozdziału jednorodnych mieszanin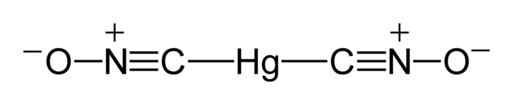 Lewis Struktura rtęci fulminat. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Lewis Struktura rtęci fulminat. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. W stanie stałym, chociaż związek C-HG-C jest liniowy, a grupa CNO jest również, związek N-C-HG odbiega od liniowości w 11 °, to znaczy ma kąt 169 °.
 Cząsteczka HG (CNO)2 W stanie stałym. Gray = rtęć; Czarny = węgiel; niebieski = azot; Czerwony = tlen. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Cząsteczka HG (CNO)2 W stanie stałym. Gray = rtęć; Czarny = węgiel; niebieski = azot; Czerwony = tlen. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. Jednak zgodnie z wyżej wymienionym badaniem w stanie gazowym pełna cząsteczka jest całkowicie liniowa.
Nomenklatura
- Merkury Fulmate
- Mercuric Fulminate
- Rtęć różni się
- Merkury Bisfulminate
- Kwas fulminowy sól rtęciowa
- Poruszający rtęć
- Wybuchowy rtęć
Nieruchomości
Stan fizyczny
Biały do pomarańczowej stałych stałych.
 HG (CNO)2 zwilżone stałe. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
HG (CNO)2 zwilżone stałe. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Waga molekularna
284,63 g/mol
Temperatura topnienia
Nie topi się. Ogrzewanie w temperaturze ponad 100 ° C.
Gęstość
4,42 g/cm3
Rozpuszczalność
Lekko rozpuszczalne w wodzie. Rozpuszczalny w etanolu (c2H5OH) i wodorotlenek amonu (NH4OH).
Właściwości chemiczne
Jest to bardzo wybuchowy związek i bardzo wrażliwy na ciosy, uderzenia lub tarcia. Możesz łatwo detonować za pomocą iskry i płomieni. Kiedy rozkłada się na kształt gazów rtęci (HG), tlenku węgla (CO) i azotu (n2).
Z kwasem siarkowym (h2południowy zachód4) Koncentrat występuje również gwałtowna detonacja. Kwas solny rozpuszcza go częściowo i występuje chlorek rtęciowy.
Według badania przeprowadzonego w 1981 r., Jeśli ulega ono kontrolowanemu i bardzo powolnemu, w obojętnej atmosferze argonowej, gdy osiągnie 120 ° C, występuje niekuplozycyjny rozkład i powstaje stał.
Jest to związek, który był badany przez rzadkie czasy pod kątem jego niebezpieczeństwa, a takie możliwości badań były bardzo odległe od siebie. Musisz pracować w ciemności, aby uniknąć wybuchów. Jego próbki powinny być trzymane pod wodą i bez światła.
 HG Solid (CNO)2 Zachowaj pod wodę. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
HG Solid (CNO)2 Zachowaj pod wodę. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Uzyskanie
Po jego odkryciu nastąpiło komercyjnie poprzez reakcje między etanolem (Cho3Ch2OH), rtęć (hg) i kwas azotowy (HNO3).
Może ci służyć: równanie Clausius-clapeyron: po co to jest przykłady, ćwiczeniaW jednym z najważniejszych badań struktury tego związku naukowcy sugerują, że aby uzyskać większą wydajność podczas ich przygotowania, pierwszą połowę całkowitej objętości etanolu należy dodać do mieszanki HG i HNO3 Zanim znikną brązowe gazy.
Innymi słowy, ważne jest, aby tlenki azotu były obecne, aby reakcja trwała.
To, co dzieje się pierwszym, to przekształcenie etanolu do aldehydu octowego. Zgodnie z niektórymi badaniami, następnie większe utlenianie, nitrowanie, dekarboksylacja i eliminacja kwasu azotowego.
Używam jako agenta detonacyjnego innych materiałów wybuchowych
Aplikacje wojenne
Pierwsze próby wykorzystania rtęci fulminacji jako wybuchowego kurzu broni palnej były sfrustrowane niezwykłą prędkością i przemocą ich detonacji.
Pistolety i strzelby zostały zniszczone przez małe ładunki tego związku. Stało się to również z dziełami artylerii i granatów w testach wojskowych.
Jednak w 1822 r. Następnie w Bretanii jego użycie w muszkietach piechoty zostało wdrożone, a następnie w całej Europie.
 W dziewiętnastym wieku fulmination Merkurego zastosowano jako detonator wielu rodzajów broni wojennej. Autor: Vetsikas Dimitris. Źródło: Pixabay.
W dziewiętnastym wieku fulmination Merkurego zastosowano jako detonator wielu rodzajów broni wojennej. Autor: Vetsikas Dimitris. Źródło: Pixabay. Do początku XX wieku był to jedyny detonator używany do strzelania po pociskach, dopóki nie zostały wdrożone inne alternatywy z bezpieczniejszymi i dostępnymi związkami.
Pokojowe zastosowania
Ten związek odegrał ważną rolę w rozwoju materiałów wybuchowych do celów pokojowych.
Jego rola w wynalezieniu dynamitu przez Alfreda Nobla była bardzo znacząca. Ten naukowiec połączył nitroglicerynę, potężny materiał wybuchowy, z porowatym materiałem, Ziemią okrzemek. Ale detonacja tej mieszanki jest trudna z iskry lub knotami.
Nobel przekroczył tę trudność przy użyciu fulminatów rtęciowych, które były wiarygodne w ich zastosowaniu. Ta kombinacja pozwala obecnie na wykorzystanie wydobycia, eksploatacji kamieniołomu, budowy tunelu i inżynierii lądowej do budowy dróg, kolei, portów itp.
Może ci służyć: Buteno Był szeroko stosowany jako detonator wybuchów w budowie górniczej i dróg. Autor: Nyamdorj. Źródło: Pixabay.
Był szeroko stosowany jako detonator wybuchów w budowie górniczej i dróg. Autor: Nyamdorj. Źródło: Pixabay. Alfred Nobel sam podkreślił podstawowe znaczenie rtęci w rozwoju inżynierii lądowej, które promowały dynamit.
Ryzyko
Jest to bardzo niestabilny i wyjątkowo wybuchowy związek.
 Autor: Clker-Free-Vector-Images. Źródło: Pixabay.
Autor: Clker-Free-Vector-Images. Źródło: Pixabay. Powoduje ostrą toksyczność. Jest toksyczny, jeśli jest połknięty, wdychany lub jeśli wchodzi w kontakt ze skórą. Łatwo wytwarza kontaktowe zapalenie skóry. Powoduje uszkodzenie narządów wewnętrznych, jeśli dana osoba jest odsłonięta lub przedłużona.
Bardzo toksyczne dla życia wodnego i naziemnego z ciągłym długoterminowym niebezpieczeństwem.
Bibliografia
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- LUB.S. National Library of Medicine. (2019). Merkury Difulminate. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Munroe, c.I. (1912). Uwaga na temat produkcji fulminacji rtęci. Journal of Industrial & Engineering Chemistry 1912, 4, 2, 152-153. Odzyskane z pubów.ACS.org.
- Kurzer, f. (2000). Kwas fulminowy w historii chemii organicznej. J Chem. Edukacja. 2000, 77, 7, 851. Odzyskane z pubów.ACS.org.
- Beck, w. i Klapötke, T.M. (2008). Merkury Fulminate: ONC-HG-CNO lub CNO-HG-ENC-A Badanie DFT. Journal of Molecular Structure: Theochem 848 (2008) 94-97. Odzyskane z naukowym.com.
- Wilson, e. (2007). Mercury Fulmine został przesunięty. Chemical & Engineering News Archive 2007, 85, 36, 10. Odzyskane z pubów.ACS.org.
- Brown, m.I. i Swallowe, G.M. (1981). Rozkład termiczny soli srebra (I) i rtęci (II) 5-nitrotetrazolu i rtęci (ii) fulminacji. Thermochimica Acta, 49 (1981) 333-349. Odzyskane z naukowym.com.
- Alderson, godz.I. (1910). Do nowej dermatozy powołania. Zapalenie skóry z powodu suchego fulminacji rtęci. Cal State J Med 1910 AP; 8 (4): 114. NCBI odzyskało.NLM.Nih.Gov.
- Fundacja Wikimedia (2020). Rtęć (ii) fulminacja. Odzyskane z.Wikipedia.org.
- « Struktura chlorku rtęci (II), właściwości, uzyskiwanie, zastosowania
- Cechy i wkład cywilizacji rolniczych »

