Struktura chlorku rtęci (II), właściwości, uzyskiwanie, zastosowania

- 2842
- 560
- Pani Gilbert Stolarczyk
On Chlorek rtęci (ii) Jest to związek nieorganiczny utworzony przez atom metalowego rtęci (HG) i dwa atomy chloru halogenu (CL). Merkury jest w stanie +2 utleniania i chloru -1.
Jego formuła chemiczna to HGCL2. Jest to lekko lotna krystaliczna stała w temperaturze pokojowej. Związki wśród ich atomów są bardziej kowalencyjne niż jonowe.
 Chlorek rtęci (ii). Mrgreen71/cc by-sa (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Chlorek rtęci (ii). Mrgreen71/cc by-sa (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Podczas rozpuszczania się w wodzie utrzymuje swoją strukturę molekularną. Jest również rozpuszczalny w kilku rozpuszczalnikach organicznych. Światłem światła ma tendencję do tworzenia metalicznego rtęci.
W przeszłości był stosowany jako antyseptyczny i leczony niektórymi chorobami zakaźnymi, zarówno u ludzi, jak i zwierząt. Również jako owadobójca w celu kontroli szkodników, takich jak mrówki i termity.
Jednak gdy ich wysoka toksyczność jest weryfikowana, większość z tych zastosowań została porzucona i jest obecnie stosowana tylko w laboratoriach analizy chemii lub analizy biochemicznej.
Może wykorzystać w określonych warunkach. Jest to trujący związek, powoduje szkodę dla ludzi, zwierząt i roślin. Nigdy nie należy go odrzucić do środowiska. Podejrzewa się również, że jest rakotwórczym.
[TOC]
Struktura
Chlorek rtęci składa się z Hg w utlenianiu II i chloru z walencją -1. W tym haluro powiązania między atomami mają bardzo wyraźny kowalencyjny charakter.
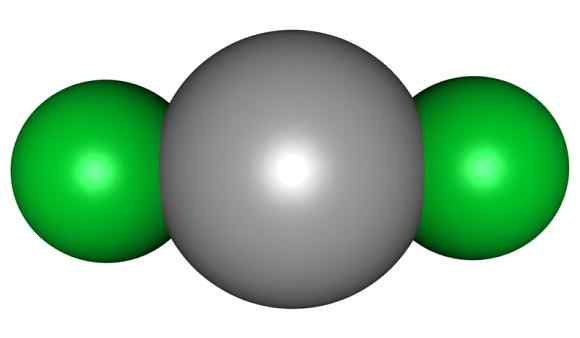 Cząsteczka HGCL2. Gray = rtęć; Zielony = chlor. Arrowsmaster / Public Domena. Źródło: Wikimedia Commons.
Cząsteczka HGCL2. Gray = rtęć; Zielony = chlor. Arrowsmaster / Public Domena. Źródło: Wikimedia Commons. Oznacza to, że w szklance związek utrzymuje swoją strukturę molekularną Cl-HG-CL, gdzie odległość Hg-Cl jest podobna do tego, gdy jest w stanie gazowym, podczas gdy w szklance odległość z atomami chloru innych cząsteczek jest dużo osoby starsze.
 Układ cząsteczek HGCL2 W szklance. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Układ cząsteczek HGCL2 W szklance. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. W stanie gazowym jest wyraźnie molekularny, a także w roztworze wodnym.
Nomenklatura
- Chlorek rtęci (ii)
- Chlorek rtęciowy
- Merkury Bichlorek
- Dicloromercurio
Nieruchomości
Stan fizyczny
Białe krystaliczne stałe, rombowe kryształy.
 Stały chlorek rtęciowy. Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Stały chlorek rtęciowy. Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Waga molekularna
271,5 g/mol
Temperatura topnienia
280 ° C
Punkt sublimacji
W 300 ° C sublima, to znaczy, pochodzi bezpośrednio z ciał gazowych.
Gęstość
5,6 g/cm3
Rozpuszczalność
Mało rozpuszczalny w wodzie: 7,31 g/100 ml w 25 ° C. Alkohol rozpuszczalny: 33 g/ 100 ml w 25 ° C. Rozpuszczalny octan etylu. Mały rozpuszczalny w eterze: 4 g/100 ml. Coś rozpuszczalnego w benzene.
Może ci służyć: Helmholtz Free Energy: Jednostki, sposób jej obliczania, rozwiązywane ćwiczeniaPh
Roztwór 0,2 mole/l ma pH 3,2-4,7.
Właściwości chemiczne
W roztworze wodnym istnieje prawie wyłącznie (∼ 99%) w postaci cząsteczki HGCL2. Jednak cierpi z powodu hydrolizy:
HGCL2 + H2Lub ⇔ Hg (OH) Cl + H+ + Cl-
HGCL2 + 2 godz2Lub ⇔ Hg (OH)2 + 2 godz+ + 2 Cl-,
Przedstawia wyraźną rozpuszczalność w rozpuszczalnikach organicznych, w których przybiera formę dimerów, to znaczy dwóch związanych cząsteczek.
W obecności materii organicznej i przez działanie światła słonecznego zmniejsza się, tworząc chlorek rtęci (I) (HGCL), a następnie metaliczny rtęć.
HGCL2 + Światło słoneczne → HGCL → HG0
Z roztworem wodorotlenku sodu (NaOH) generuje żółty przedwczesny osad (HGO).
Jest niekompatybilny lub reaguje z postaciami, siarczanami, fosforanami, sulfidami, żelatyną, albuminą, alkalią, amoniakiem, wodorotlenkiem wapnia, bromek, węglanami, żelazem, miedzi, ołów, soli srebra i niektórych materiałów roślinnych.
Inne właściwości
Ze względu na najbardziej kowalencyjny niż charakter jonowy, jest nieco niestabilny w temperaturze pokojowej i jest znacznie ujęta w temperaturze 100 ° C.
Uzyskanie
Możesz przygotować utleniającą metaliczną rtęć (HG0) z gazem chloru (CL2). Podczas ogrzewania i osiągnięcia ponad 300 ° C pojawia się płomień, a zbierana para jest sublimowana, a po powstaniu kryształów HGCL2.
HG + Cl2 + Ciepło → HGCl2
Uzyskuje się również przez ogrzewanie siarczanu rtęci (II) na sucho z chlorkiem sodu. Opary HGCL2 że subliman są zbierane i skondensowane do krystalicznej substancji stałej.
HGSO4 + 2 NaCl → HGCl2 + Na2południowy zachód4
Reakcja między tlenkiem rtęci (II) z kwasem solnym w ilościach stechiometrycznych wytwarza kryształy HGCL2 Kiedy medium jest chłodzone.
HGO + 2 HCl → HGCL2 + H2ALBO
Kryształy można oczyszczyć przez rekrystalizację i sublimację.
Aplikacje
W laboratoriach chemicznych
Jest stosowany jako odczynnik w różnych analizach chemicznych. Umożliwia przygotowanie innych związków rtęciowych, takich jak jodek rtęci (II), tlenek rtęci (II), chlorek rtęci (I), chlorek amonu i rtęci (II).
Może ci służyć: fluor: historia, właściwości, struktura, uzyskiwanie, ryzyko, zastosowaniaW laboratoriach patologii
Jest częścią roztworu octowego Zenkera, który jest stosowany w leczeniu próbek lub próbek biopsji szpiku kostnego. Tkanki są szybko ustawione z doskonałymi szczegółami histologicznymi, które należy zaobserwować za pomocą mikroskopu.
 Czasami HGCL2 Jest stosowany w laboratoriach patologii. Autor: Ernesto Eslava. Źródło: Pixabay.
Czasami HGCL2 Jest stosowany w laboratoriach patologii. Autor: Ernesto Eslava. Źródło: Pixabay. Opuszczone zastosowania
W czasach średniowiecza i do początku XX był stosowany w różnych zastosowaniach, ponieważ jego szkodliwy wpływ na zdrowie był nieznany.
- Jako leczenie niektórych chorób, miejscowe antyseptyczne i dezynfekujące.
 W przeszłości HGCL2 Zastosowano go w leczeniu kiły. G. H. Lis / domena publiczna. Źródło: Wikimedia Commons.
W przeszłości HGCL2 Zastosowano go w leczeniu kiły. G. H. Lis / domena publiczna. Źródło: Wikimedia Commons. - W medycynie weterynaryjnej jako środek żrący, dezynfekujący i antyseptyczny.
- W rolnictwie działał jako grzybobójstwo, kontrolować robaki lądowe, takie jak owadobójcy i odstraszający karaluchy, mrówki i termity, a także jako dezynfekujący w celu ochrony nasion i żarówek.
- W przypadku ochrony drewna środek chemiczny do balsamu i oszczędzania próbek anatomicznych.
- Jako katalizator uzyskiwania chlorku winylu z acetylenu.
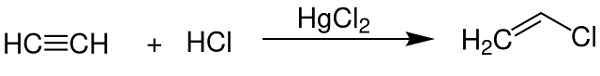 Chlorek rtęci (II) służy jako katalizator w uzyskaniu niektórych związków chemicznych. Chem Sim 2001 / Public Domena. Źródło: Wikimedia Commons.
Chlorek rtęci (II) służy jako katalizator w uzyskaniu niektórych związków chemicznych. Chem Sim 2001 / Public Domena. Źródło: Wikimedia Commons. - W elektrodzie aluminiowej.
- Aby zaznaczyć żelazo i stal.
- Jako odczynnik fotograficzny.
- W drukowaniu tkanin, jako mordant dla królików i futrów, barwnika drewnianego.
- Jako element suszonych baterii.
Ryzyko
Do zdrowia
Jest to żrący i wyjątkowo toksyczny związek, jeśli jest spożywany, ponieważ może powodować śmierć. Atakuje przewód pokarmowy i układ nerkowy. Powodują ciężkie oparzenia na skórze i oczach.
Przedłużone lub powtarzające się narażenie na ten związek powoduje uszkodzenie narządów wewnętrznych. Wszystkie formy rtęci są trujące, a HGCL2 jest jednym z najbardziej toksycznych.
Podejrzewa się, że jest to rakotwórczy, który powoduje wady genetyczne i uszkodzenie płodności.
Niebezpieczeństwo ognia
Chociaż nie jest to paliwo, może eksplodować podczas stosowania ciepła. Kiedy rozkłada toksyczne i toksyczne gazy rtęciowe.
Mieszanki HGCL2 Z metali alkalicznych, takich jak sód lub potas, są bardzo wrażliwe na ciosy i mogą wykorzystać uderzenia. Jeśli masz kontakt z amoniakiem, siarczki, kwas szczawiowy i acetylen mogą również eksplodować.
Może ci służyć: kwas chlorowy (HCL)Wpływ na środowisko
Jest bardzo toksyczny wobec organizmów wodnych i lądowych, a jego skutki trwają z czasem. Może przedstawić bioakumulację w całym łańcuchu pokarmowym, zarówno w roślinach, jak i zwierzętach.
 Chlorek rtęciowy nigdy nie powinien być odrzucany w środowisku. Autor: Naadjuuh. Źródło: Wikimedia Commons.
Chlorek rtęciowy nigdy nie powinien być odrzucany w środowisku. Autor: Naadjuuh. Źródło: Wikimedia Commons. Wpływa na oddychanie, fotosyntezę i inne metaboliczne ścieżki roślin, które powodują ich pogorszenie. Nie powinno to mieć wpływu na jego usposobienie w środowisku (ani woda, gleby, ani atmosfery))).
Niebezpieczna obecność w niektórych naturalnych środkach
Pomimo jego toksyczności istnieją naturalne środki i zioła, które go zawierają, więc ludzie, nie wiedząc o tym, są niebezpiecznie narażeni na ten związek.
Na przykład w tradycyjnej medycynie chińskiej Calomel lub Qing Fen zawiera trochę HGCL2. Jest to lekarstwo stosowane jako moczopędne, antyseptyczne, maści skóry, przeczyszczanie i stosowane zewnętrznie na dyskomfort uzębienia u dzieci.
 Niektóre naturalne leki kontrolowane ONZ mogą zawierać HGCL2. Autor: istoty Silvija. Źródło: Pixabay.
Niektóre naturalne leki kontrolowane ONZ mogą zawierać HGCL2. Autor: istoty Silvija. Źródło: Pixabay. Bibliografia
- LUB.S. National Library of Medicine. (2019). Chlorek rtęciowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Lester, s.C. (2010). Przetwarzanie próbek. ACTIC FIXTATATION ZENKER (Orange). W Manual of Surgical Pathology (wydanie trzecie). Odzyskane z naukowym.com.
- Clarksson, t.W. (2001). Agenci. Fizyczne i chemiczne właściwości. W Handbook of Peticid Toxicology (drugie wydanie). Odzyskane z naukowym.com.
- Fretham, s.J.B. i in. (2015). Rtęć i neurodegeneracja. Naturalne środki i zioła zawierające HG. W bioaktywnych nutraceutycznych i suplementach diety w chorobie neurogicznej i mózgu. Odzyskane z naukowym.com.
- Knight, s. i in. (2014). Rozmieszczenie i obfitość roślin wodnych - skutki człowieka. Polecki chemiczne. W zakresie modulacji w systemach ziemskich i nauk o środowisku. Odzyskane z naukowym.com.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Ciavatta, l. i Grimaldi, m. (1968). Hydroliza chlorku rtęci (II), HGCL2. Journal of Inorganic and Nuclear Chemistry, tom 30, wydanie 2, luty 1968 r., Strony 563-581. Odzyskane z naukowym.com.
- Fundacja Wikimedia (2020). Chlorek rtęci (ii). Odzyskane z.Wikipedia.org.
- « 21 meksykańskich naukowców i ich historyczny wkład
- Struktura fulminacji rtęci, właściwości, uzyskiwanie, zastosowania »

