Historia eksperymentu Rutherford, opis i wnioski
- 4185
- 1016
- Paweł Malinowski
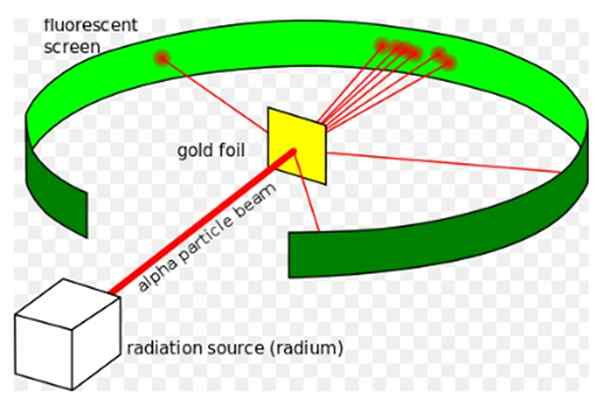
On Eksperyment Rutherford, przeprowadzone w latach 1908–1913, polegało na bombardowaniu cienkiego złotego arkusza 0.0004 mm grubości z cząstkami alfa i przeanalizuj wzór dyspersji, który te cząstki pozostawione na ekranie fluorescencyjnym.
W rzeczywistości Rutherford przeprowadził liczne eksperymenty, coraz bardziej udoskonalając szczegóły. Po dokładnej analizie wyników ujawniono dwa bardzo ważne wnioski:
-Dodatnie obciążenie atomu koncentruje się w obszarze zwanym rdzeń.
-To jądro atomowe jest niesamowicie małe w porównaniu z wielkością atomu.
 Rysunek 1. Eksperyment Rutherforda. Źródło: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Rysunek 1. Eksperyment Rutherforda. Źródło: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Ernest Rutherford (1871–1937) był fizykiem urodzonym w Nowej Zelandii, którego zainteresowaniem była radioaktywność i charakter materii. Radioaktywność było niedawnym zjawiskiem, gdy Rutherford rozpoczął eksperymenty, odkrył go Henri Becquerel w 1896 roku.
W 1907 r. Rutherford przeprowadził się na University of Manchester w Anglii, aby zbadać strukturę atomu, wykorzystując te cząstki alfa jako sondy w celu zbadania wnętrza tak niewielkiej struktury. Fizycy Hans Geiger i Ernest Marsden towarzyszyli mu w zadaniu.
Mieszkali w nadziei na zobaczenie, w jaki sposób cząstka alfa, która jest podwójnie jonizowanym atomem helu, oddziaływał z unikalnym atomem złotym, aby zapewnić, że wszelkie odchylenia, których doświadczył, wynika wyłącznie z siły elektrycznej.
Jednak większość cząstek alfa przekroczyła złoty arkusz cierpiący tylko na małe odchylenie.
Fakt ten był całkowicie zgodny z modelem atomowym Thomsona, jednak ku zaskoczeniu naukowców niewielki odsetek cząstek alfa doświadczył dość niezwykłego odchylenia.

I jeszcze mniejszy odsetek cząstek, podskakując całkowicie do tyłu. Dlaczego te nieoczekiwane wyniki były?
[TOC]
Opis i wnioski z eksperymentu
W rzeczywistości cząsteczki alfa, które Rutherford stosował jako sonda, są jądro helu, i wtedy wiadomo tylko, że cząstki te miały ładunek dodatni. Dziś wiadomo, że cząstki alfa składają się z dwóch protonów i dwóch neutronów.
Cząstki Alfa i beta zostały zidentyfikowane przez Rutherford jako dwa różne rodzaje promieniowania z uranu. Cząstki alfa, znacznie bardziej masowe niż elektron, mają dodatni ładunek elektryczny, podczas gdy cząstki beta mogą być elektrony lub pozytry.
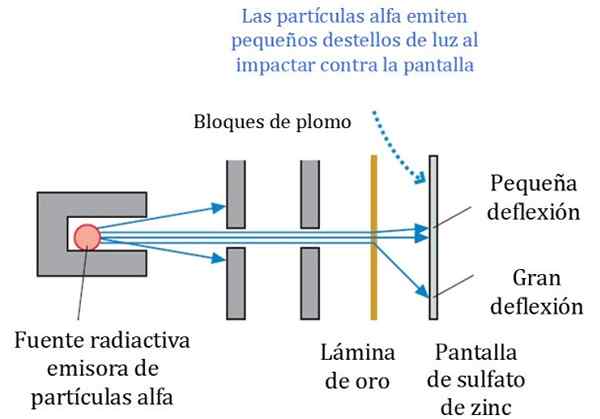 Rysunek 2. Szczegółowy schemat eksperymentu Rutherford, Geiger i Marsden. Źródło: r. Rycerz. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
Rysunek 2. Szczegółowy schemat eksperymentu Rutherford, Geiger i Marsden. Źródło: r. Rycerz. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba. Rysunek 2 pokazuje uproszczony schemat eksperymentu. Wiązka cząstek alfa pochodzi ze źródła radioaktywnego. Geiger i Marsden używali gazu radonu jako emitera.
Bloki ołowiowe zastosowano do skierowania promieniowania do złotego arkusza i zapobiegania ich zatrzymywaniu się bezpośrednio na ekran fluorescencyjny. Ołów jest materiałem, który pochłania promieniowanie.
Może ci służyć: centriole: funkcje i cechyNastępnie ukierunkowana wiązka była pod wpływem cienkiego złota, a większość cząstek podąża ich drogą do ekranu siarczanu cynku fluorescencyjnego, gdzie pozostawili mały lekki ślad stóp. Geiger był odpowiedzialny za liczenie ich jeden po drugim, chociaż następnie zaprojektowali urządzenie, które to zrobiło.
Fakt, że niektóre cząstki doświadczyły małego ugięcia, nie zaskoczył Rutherford, Geiger i Marsden. W końcu w atomie występują ładunki dodatnie i ujemne, które wywierają siłę na cząstki alfa, ale ponieważ atom jest neutralny, co już wiedzieli, odchylenia powinny być małe.
Zaskoczeniem eksperymentu jest to, że kilka dodatnich cząstek zostało odrzuconych niemal bezpośrednio.
Wnioski
Około 1 na 8000 cząstek alfa doświadczyło ugięcia u kątów większych niż 90º. Niewiele, ale wystarczy, aby zakwestionować niektóre rzeczy.
Model atomowy w Boga był modelem Thomsona, byłego profesora Rutherford w Cavendish Laboratory, ale zastanawiał się, czy pomysł atomu bez jądra i z elektronami osadzonymi jako rodzynki, było to prawda.
Ponieważ okazuje się, że te wielkie ugięcie cząstek alfa i fakt, że kilka jest w stanie powrócić, można to wyjaśnić tylko wtedy, gdy atom ma mały, ciężki i pozytywny rdzeń. Rutherford założył, że tylko siły przyciągania i odpychania elektrycznego, jak wskazano w prawie Coulomba, były odpowiedzialne za wszelkie odchylenie.
Gdy niektóre cząstki alfa zbliżają się bezpośrednio do jądra, a ponieważ siła elektryczna zmienia się w zależności od kwadratu odległości, odczuwają odpychanie, które powodują rozproszenie wielkiego kąta lub odchylenie do tyłu.
Aby zapewnić, Geiger i Marsden doświadczyli arkuszy bombardowania różnych metali, nie tylko złota, chociaż ten metal był najbardziej odpowiedni dla ich plastyczności, aby stworzyć bardzo drobne arkusze.
Uzyskując podobne wyniki, Rutherford przekonał, że dodatnie obciążenie atomu powinno być zlokalizowane w jądrze, a nie rozproszone w całym objętości, jak Thomson postulował w swoim modelu.
Z drugiej strony, podobnie jak zdecydowana większość cząstek alfa, zdarzyło się to bez odchylenia, rdzeń powinien być bardzo, bardzo mały w porównaniu z rozmiarem atomowym. Jednak jądro to musiało skoncentrować większość masy atomu.
Wpływy w modelu atomowym
Wyniki były bardzo zaskoczone Rutherford, który ogłosił na konferencji w Cambridge: „… To tak, jakbyś strzelał 15 -calową kulę armaty na arkuszu z jedwabnej papieru i pocisku podskakuje bezpośrednio do ciebie i uderza w ciebie".
Może ci służyć: 10 funkcji teoretycznych ram dochodzeniaPonieważ wyników tych nie można było wytłumaczyć modelem atomowym Thomsona, Rutherford zaproponował, aby atom powstał jądro, bardzo małe, bardzo masywne i pozytywnie załadowane. Elektrony pozostały opisujące wokół nich orbity, które system miniaturowy słoneczny.
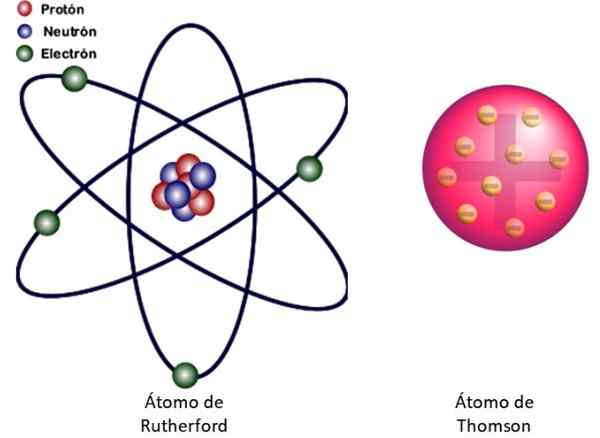 Rysunek 3. Po lewej stronie model atomowy Rutherford i po prawej model Buddin typu Thomsona. Źródło: Wikimedia Commons. Lewy obraz: JCYMC90 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Rysunek 3. Po lewej stronie model atomowy Rutherford i po prawej model Buddin typu Thomsona. Źródło: Wikimedia Commons. Lewy obraz: JCYMC90 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Jest to model jądrowy atomu pokazanego na rycinie 3 po lewej stronie. Ponieważ elektrony są bardzo, bardzo małe, okazuje się, że atom jest prawie wszystkim .. . pusty! Dlatego większość cząstek alfa przecina arkusz bez odchylenia.
A analogia z miniaturowym układem słonecznym jest bardzo skuteczny. Jądro atomowe odgrywa rolę słońca, zawierając prawie całą masę plus obciążenie dodatnie. Elektrony orbitują wokół nich jak planety i przenoszą obciążenie ujemne. Zestaw jest neutralny elektrycznie.
O rozmieszczeniu elektronów w atomie, eksperyment Rutherforda nic nie pokazał. Można by pomyśleć, że cząstki alfa miałyby z nimi pewną interakcję, ale masa elektronów jest zbyt mała i nie była w stanie znacząco odwrócić cząstek.
Wady w modelu Rutherford
Problemem z tym modelem atomowym było dokładnie zachowanie elektronów.
Gdyby nie były to statyczne, ale krążą krążąc z jądra atomowego w orbitach okrągłym lub eliptycznym, ukierunkowanym przez przyciąganie elektryczne, skończyliby się nabie do jądra.
Wynika to z faktu, że przyspieszone elektrony tracą energię, a jeśli tak się stanie, byłoby to zawalenie się atomu i materii.
Na szczęście tak się dzieje. Istnieje rodzaj dynamicznej stabilności, która pozwala uniknąć upadku. Kolejnym modelem atomowym, po Rutherforda, był Bohr, który udzielił odpowiedzi na to, dlaczego zawalenie się atomowe nie nastąpi.
Proton i neutron
Rutherford kontynuował eksperymenty z dyspersją. W latach 1917–1918 on i jego asystent William Kay postanowili zbombardować.
Znowu było zaskoczone, gdy wykrywając jądra wodoru. To jest równanie reakcji, pierwsza sztuczna transmutacja jądrowa nigdy nie została osiągnięta:
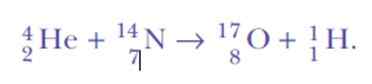 Cóż, jeśli cząstki alfa są jądro helu, skąd mogą pochodzić jądra wodoru?
Cóż, jeśli cząstki alfa są jądro helu, skąd mogą pochodzić jądra wodoru?
Odpowiedź brzmiała: z tego samego azotu. Rutherford przypisał do atomu wodoru numer 1, ponieważ jest najprostszym elementem: rdzeń pozytywny i negatywny elektron.
Rutherford znalazł podstawową cząstkę, którą nazwał proton, nazwa pochodząca od greckiego słowa Pierwszy. W ten sposób proton jest niezbędnym składnikiem każdego jądra atomowego.
Może ci służyć: objętośćPóźniej, do 1920 r., Rutherford zaproponował, że powinna istnieć neutralna cząstka i masa bardzo podobna do masy protonu. Nazywał tę cząstkę neutron i jest częścią prawie wszystkich znanych atomów. Fizyk James Chadwick w końcu zidentyfikował go w 1932 roku.
Jaki jest model skali atomu wodoru?
Atom wodoru jest, jak powiedzieliśmy, najprostszy ze wszystkich. Jednak nie było łatwo rozwinąć model dla tego atomu.
Kolejne odkrycia dały powstanie fizyki kwantowej i całej teorii, która opisuje zjawiska poziomu atomowego. Podczas tego procesu ewoluował również model atomowy. Ale zobaczmy trochę pytania o rozmiarach:
Atom wodoru ma jądro złożone z protonu (dodatnie) i ma pojedynczy elektron (ujemny).
Promień atomu wodoru oszacowano na 2.1 x 10-10 m, podczas gdy proton ma 0.85 x 10 -piętnaście m lub 0.85 Femtometers. Nazwa tego małego urządzenia jest spowodowana Enrico Fermi i jest często używana podczas pracy na tej skali.
Cóż, iloraz między promieniem atomu a jądrem jest rzędu 105 M, to znaczy atom jest 100 000 razy większy niż jądro!.
Musimy jednak pamiętać, że we współczesnym modelu, w oparciu o mechanikę kwantową, elektron obejmuje jądro w rodzaju chmury zwanej orbitalny (Orbital nie jest orbitą), a elektron w skali atomowej nie jest punktualny.
Gdyby atom wodoru jest szeroko rozszerzony - do wielkości boiska piłkarskiego, wówczas jądro złożone z dodatni proton byłby wielkością mrówki na środku pola, podczas gdy elektron ujemny byłby jak rodzaj ducha, rozproszone po polu i otaczające jądro dodatnie.
Model atomowy dzisiaj
Ten „planetarny” model atomowy jest bardzo zakorzeniony i jest obrazem, który większość ludzi ma z atomu, ponieważ jest bardzo łatwa do wizualizacji. Jednakże, to nie jest Model zaakceptowany dzisiaj w dziedzinie naukowej.
Współczesne modele atomowe oparte są na mechanice kwantowej. Wskazuje, że elektron w atomie nie jest niewielkim punktem z obciążeniem ujemnym, które następuje po precyzyjnych orbitach, takich jak te wyobrażone przez Rutherford.
Przeciwnie, elektron jest rozsiany Na obszarach, wokół dodatniego jądra, zwanego Orbitale atomowe. Od niego możemy wiedzieć prawdopodobieństwo spotkać się w tym czy innym stanie.
Mimo to model Rutherford oznaczał ogromny postęp w wiedzy o wewnętrznej strukturze atomu. I napadli na drogę dla większej liczby badaczy, aby nadal to doskonalili.
Bibliografia
- Andriessen, m. 2001. Kurs HSC. Fizyka 2. Jacaranda HSC Science.
- Arfken, g. 1984. Fizyka uniwersytecka. Academic Press.
- Knight, r. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Fizyka OpenLab. Eksperyment Rutherford-Geiger-Marsden. Odzyskane z: Physicsopenlab.org.
- Rex, a. 2011. Podstawy fizyki. osoba.
- Tyson, t. 2013. Eksperyment rozpraszania Rutherford. Odzyskane z: 122.Fizyka.UCDavis.Edu.
- Xaktly. Eksperymenty Rutherforda. Odzyskane z: xaktly.com.
- Wikipedia. Eksperyment Rutherford. Odzyskane: to jest.Wikipedia.org.
- « Charakterystyka odżywiania autotrofów, etapy, typy, przykłady
- Anna Freud biografia, teorie, mechanizmy obronne, prace »

