Struktura trzeciorzędowa głównych cech cech

- 828
- 227
- Pani Waleria Marek
Trzeciorzędowa struktura białek Jest to trójwymiarowa konformacja, którą nabywają łańcuchy polipeptydowe. Ta konformacja pojawia się przez interakcje między łańcuchami bocznymi odpadów aminokwasowych na polipeptyd. Łańcuchy boczne mogą oddziaływać niezależnie od pozycji w białku.
Ponieważ zależy to od interakcji między grupami R, struktura trzeciorzędowa pokazuje nierepetyczne aspekty łańcucha, ponieważ grupy te są różne dla każdej reszty aminokwasowej. Z drugiej strony struktura wtórna zależy od grup karboksylowych i aminowych, które są obecne we wszystkich aminokwasach.
 Struktura trzeciorzędowa białka fosfatazy kinazy, ze strukturami wtórnymi w alfa i liściach beta. Zrobione i zredagowane z: A2-33. Zmodyfikowany przez Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Struktura trzeciorzędowa białka fosfatazy kinazy, ze strukturami wtórnymi w alfa i liściach beta. Zrobione i zredagowane z: A2-33. Zmodyfikowany przez Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Niektórzy autorzy sugerują, że białka włókniste mają prostą strukturę trzeciorzędową, ale mimo to inni autorzy wskazują, że ta struktura jest typowa dla białek kulistych.
[TOC]
Włókniste białka
W białkach włóknistych łańcuchy polipeptydowe są ułożone w postaci długich włókien lub długich arkuszy; Zasadniczo składają się z unikalnego rodzaju struktury wtórnej. Ta wtórna struktura jest w większości przypadków ważniejsza niż struktura trzeciorzędowa w określaniu kształtu białka.
Jego funkcją biologiczną jest strukturalna, nadaje siłę i/lub elastyczność narządom i strukturom, w których są znalezione, jednocześnie utrzymując je razem. Wszystkie włókniste białka są nierozpuszczalne w wodzie, ze względu na dużą ilość hydrofobowych aminokwasów, które przedstawiają.
Wśród tych włóknistych białek są keratyny i kolagen. Te pierwsze znajdują się w tkaninach spójnych i w strukturach takich jak włosy, paznokcie (α-kweratyny), skale i pióra (β-cheatin). Tymczasem kolagen znajduje się między innymi w kościach, ścięgnach i skórze.
α-zapytanie
Białka te są częścią, które pomyślane włókna włókien SO -called, które odgrywają ważną rolę w cytoszkielecie organizmów wielokomórkowych. Ponadto są głównym składnikiem włosów, paznokci, wełny, rogów, kopyt i jednego z głównych białek skóry zwierząt.
Może ci służyć: barwienie kinyounStruktura cząsteczki jest śmigło α. Dwie nici α-kweratyny można ułożyć równolegle i zapisać się na drugie z ich grupami hydrofobowymi oddziałującymi między nimi. W ten sposób tworzona jest struktura nadpheliczna lub kulowa z uzwojeniem po lewej stronie.
Struktura trzeciorzędowa keratyny α jest prosta i jest zdominowana przez wtórną strukturę α-helisy. Z drugiej strony obecna jest również struktura czwartorzędowa, ponieważ dwie cząsteczki uczestniczą w strukturze nadpheloidalnej, która oddziałuje poprzez wiązania niekowalencyjne.
β-pytaniny
Pierwotna struktura jest podobna do struktury α-kweratyn, ale jej wtórna struktura jest zdominowana przez arkusze β. Są głównym składnikiem łusek gadów i piór ptaków.
Kolagen
To białko może reprezentować ponad 30% całkowitej masy białka niektórych zwierząt. Występuje między innymi w chrząstkach, kościach, ścięgnach, rogówki i skórze.
Drugorzędna struktura kolagenu jest unikalna, reprezentowana przez śmigło Levogiry z 3,3 odpadami aminokwasowymi dla każdego okrążenia. Trzy łańcuchy śmigła Levogyous (α).
Cząsteczki tropocollagenowe łączą się, tworząc włókno kolagenowe, które ma wielką oporność, wyższą niż stal i porównywalna z miedzią o wysokiej oporności.
Inne włókniste białka
Inne rodzaje białek włóknistych to fibroina i elastyna. Pierwszy z nich powstaje przez arkusze β, głównie składane przez glikinę, alaninę i serynę.
Boczne łańcuchy tych aminokwasów są małe, więc można je dokładnie zapakować. Rezultatem jest błonnik, który jest zarówno bardzo odporny, jak i bardzo nieusuwany.
Może ci służyć: bufor fosforanowy (PBS): podkład, przygotowanie i zastosowaniaTymczasem w elastynie valina zastępuje serynę wśród głównych składowych aminokwasów. W przeciwieństwie do fibroine, elastyna jest bardzo rozszerzalna, stąd jej nazwa. W konstytucji cząsteczki lizyna działa również, która może uczestniczyć w krzyżowaniu, które pozwalają elastynie odzyskać kształt.
Białka kuliste
Białka kuliste, w przeciwieństwie do włóknistej, są rozpuszczalne i ogólnie mają kilka rodzajów struktur wtórnych. Jednak w nich są ważniejsze trójwymiarowe konformacje, które nabywają podczas składania siebie (struktura trzeciorzędowa).
Te szczególne trzy -wymiarowe konformacje dają specyficzną aktywność biologiczną każdego białka. Główna funkcja tych białek jest regulacyjna, jak w przypadku enzymów.
Charakterystyka trzeciorzędowej struktury białek kulistych
Trzeciorzędowa struktura białek kulistych ma pewne ważne cechy:
- Białka kuliste są kompaktowe dzięki opakowaniu, gdy rozkłada się łańcuch polipeptydowy.
- Odległe odpady aminokwasowe w pierwotnej strukturze łańcuchów polipeptydowych są bliskie, jest w stanie oddziaływać ze sobą z powodu składania.
- Większe białka kuliste (ponad 200 aminokwasów) mogą mieć kilka zwartych segmentów, niezależnych między nimi i z poszczególnymi funkcjami, a każdy z tych segmentów nazywa się domeną. Domena może mieć od 50 do 350 odpadów aminokwasowych.
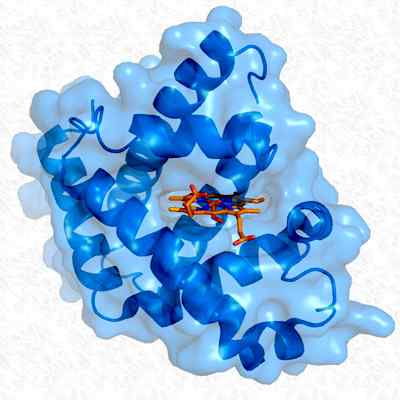 Struktura trzeciorzędowa mioglobiny. Zrobione i zredagowane z: Thomas Splettstoesser. Zmodyfikowany przez Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Struktura trzeciorzędowa mioglobiny. Zrobione i zredagowane z: Thomas Splettstoesser. Zmodyfikowany przez Alejandro Porto. [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Ogólne zasady fałdowania globalnych białek
Jak już wspomniano, białka mają szczególne formy składania, które nadają im również szczególne cechy. To składanie nie jest losowe i jest faworyzowane zarówno przez strukturę pierwotną, jak i wtórną, jak i przez niektóre interakcje niekowalencyjne, a także pewne fizyczne ograniczenia dotyczące składania, więc sformułowano niektóre zasady:
Może ci służyć: pierwotne narządy limfatyczne- Wszystkie białka kuliste mają zdefiniowane wzorce rozkładu, z grupami hydrofobowymi skierowanymi do cząsteczki i odpadów hydrofilowych w warstwie zewnętrznej w warstwie zewnętrznej. W tym celu wymagane są co najmniej dwie warstwy struktury wtórnej. Pętla β-α-β i wierzchołek α-α mogą przyczynić się do tych dwóch warstw.
- Arkusze β są ogólnie ułożone w postać zwiniętą Levogira.
- W łańcuchu polipeptydowym mogą wystąpić różne zakręty, aby przejść z wtórnej do innej struktury, takiej jak zakręty β lub γ, które mogą być w stanie zainwestować kierunek łańcucha w cztery odpady aminokwasowe lub mniej lub mniej.
- Białka kuliste mają arkusze α, β, nieregularnie ustrukturyzowane zwroty akcji.
Denaturacja białka
Jeśli białko straci swoją natywną (naturalną) trójwymiarową strukturę, traci swoją aktywność biologiczną i większość swoich specyficznych właściwości. Proces ten jest znany jako denaturacja.
Denaturacja może wystąpić, gdy zmieniają się naturalne warunki środowiskowe, na przykład przez różną temperaturę lub pH. Proces jest nieodwracalny w wielu białkach; Jednak inni mogą spontanicznie odzyskać naturalną strukturę, przywracając normalne warunki środowiskowe.
Bibliografia
- C.K. Mathews, k.I. Van Hold & K.G. Ahern (2002). Biochemery. 3. edycja. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, s. 1. Mayes, d.C. Granner i V.W. Rodwell (1996). Biochemeryka Harpera. Appleton i Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemery. 5. edycja. W. H. Freeman and Company.
- W.M. Becker, L.J. Kleinsmith i J. Hardin (2006) World of the Cell. 6. edycja. Pearson Education Inc.
- DO.Lehninger (1978). Biochemia. Omega Editions, S.DO.
- T. McKee i J.R. McKee (2003). Biochemia: molekularna podstawa życia. Wydanie trzecie. McGraw-Hiii Companies, Inc.
- « Fermioniczne właściwości kondensatu, zastosowania i przykłady
- Struktura, właściwości, właściwości, właściwości, właściwości, właściwości »

