Wtórna struktura białek charakterystycznych

- 2161
- 145
- Filip Augustyn
Wtórna struktura białka Jest to nazwa definiująca konformację złożoną lokalnie w niektórych częściach łańcucha polipeptydowego. Ta struktura składa się z kilku wzorców, które są regularnie powtarzane.
Istnieje wiele sposobów składania łańcuchów białek. Jednak tylko kilka z tych form jest bardzo stabilna. W naturze najczęstszymi postaciami, które nabywają białka, są śmigło α, a także arkusz β. Struktury te można opisać pod kątem łącza ψ (Psi) i φ (Phi) odpadów aminokwasowych.
 Schemat i model piłek i prętów helisy Alfa białek (struktura wtórna). Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Schemat i model piłek i prętów helisy Alfa białek (struktura wtórna). Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Interakcje ustalone między łańcuchami bocznymi odpadów aminokwasowych mogą pomóc ustabilizować lub, w przeciwieństwie do destabilizacji wtórnej struktury białek. Wtórną strukturę można zaobserwować w konstytucji wielu włóknistych białek.
[TOC]
Historia
W dekadzie 30. ubiegłego wieku William Atsbury, pracujący z x -działającymi, stwierdził, że białko włosów, a także kolców porkospin, posiadane w ich segmentach struktury, które były regularnie powtarzane.
W oparciu o te wyniki i wiedzę na temat znaczenia wiązań wodorowych w orientacji grup polarnych wiązań peptydowych, William Pauling i współpracowników, w konsekwencji określili hipotetycznie możliwe regularne konformacje, które białka mogą mieć.
Pauling i jego współpracownicy, w latach 50. XX wieku, ustanowili kilka postulatów, które musiały zostać spełnione w połączeniach łańcuchów polipeptydowych, w tym, a przede wszystkim, że dwa atomy nie mogą się ze sobą zbliżać w odległości mniej niż odległość od ich odpowiedniej Radia Van der Waalsa.
Wskazali również, że potrzebne są linki nieokowaleniowe, aby ustabilizować fałdowanie łańcuchów.
Może ci służyć: reprodukcja płciowaNa podstawie tych postulatów i wcześniejszej wiedzy oraz przy użyciu modeli molekularnych, udało im się opisać pewne regularne konformacje białek, w tym, które następnie wykazały, że były one najczęstsze z natury, takie jak śmigła α i blaszka β β β β.
Śmigło α
Jest to najprostsza struktura wtórna, w której łańcuch polipeptydowy jest ułożony w zwiniętym i zagęszczonym kształcie wokół wyobrażonej osi. Ponadto łańcuchy boczne każdego aminokwasu wyróżniają.
W tym przypadku aminokwasy są ułożone w sposób, w jaki mają kąty łącza ψ Od -45 ° do -50 ° i φ -60 °. Kąty te odnoszą się do związku między węglem α a tlenem karbonylu i wiązaniem między azotem a węglem α każdego aminokwasu.
Ponadto naukowcy ustalili, że dla każdego zakrętu śmigła α przedstawiono 3,6 odpadów aminokwasowych i że ten zwrot jest zawsze dekstrogiry w białkach. Oprócz tego, że jest najprostszą strukturą, śmigło α jest dominującą postacią w α-kweratynach i około 25% aminokwasów białek kulistych przyjmuje tę strukturę.
Śmigło α jest stabilizowane dzięki faktowi, że przedstawia wiele mostów wodorowych. Zatem trzy lub cztery linki tego typu są ustalone w każdej turze śmigła.
W mostach wodoru azot wiązania peptydowego i atom tlenu grupy karbonylowej kolejnych oddziaływania aminokwasów, w kierunku aminowej strony tego łańcucha.
Naukowcy wykazali, że śmigło α można uformować z łańcuchami polipeptydowymi utworzonymi przez L- lub D-aminokwasy, ze stanem, że wszystkie aminokwasy mają tę samą konfigurację stereoizomerów. Ponadto naturalne l-eaminokwasy mogą tworzyć droord α z prawą i lewą.
Może ci służyć: immunoglobulina DJednak nie wszystkie polipeptydy mogą tworzyć stabilny śmigło α, ponieważ ich pierwotna struktura wpływa na stabilność tego. Łańcuchy R niektórych aminokwasów mogą zdestabilizować strukturę, zapobiegając tworzeniu się śmigieł α.
Arkusz β
W arkuszu β lub złożonym arkuszu β, każdy z odpadów aminokwasowych ma rotację o 180 ° w stosunku do poprzednich resztek aminokwasowych. W ten sposób uzyskuje się w wyniku tego, że szkielet łańcucha polipétidów jest przedłużony i w postaci zygzakowatej lub akordeonowej.
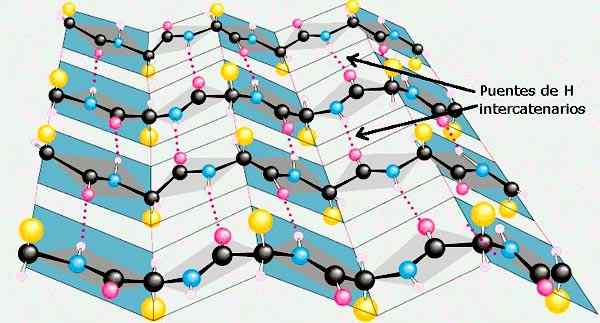
Łańcuchy polipeptydowe w kształcie akordu można umieścić w sąsiedztwie siebie i wytwarzać liniowe mosty wodorowe między obiema łańcuchami.
Dwa sąsiadujące łańcuchy polipeptydowe mogą być ułożone równolegle, to znaczy oba można zorientować w kierunku amino -karboksylowym, tworząc równoległy arkusz β; o Mogą być zlokalizowane w przeciwnych kierunkach, a następnie tworzyć arkusz Antiparalla β.
Boczne łańcuchy sąsiednich odpadów aminokwasowych wyróżniają się na podstawie szkieletu łańcucha w przeciwnych kierunkach, co daje naprzemienny wzór. Niektóre struktury białkowe ograniczają rodzaje aminokwasów struktur β.
Na przykład w gęsto pakowanych białkach, krótko łańcuchowe aminokwasy, takie jak glicyna i alanina na ich powierzchniach kontaktowych.
 Arkusz β wtórnych struktur białek. Zrobione i zredagowane z: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Arkusz β wtórnych struktur białek. Zrobione i zredagowane z: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Inne konformacje struktury wtórnej
Helix 310
Ta struktura charakteryzuje się przedstawieniem 3 odpadów aminokwasowych na rundę. Ta struktura zaobserwowano w niektórych białkach, ale nie ma bardzo częstego natury.
Helix π
Tymczasem ta struktura ma 4,4 odpadów aminokwasowych z obrotu spiralnego i 16 -elementów pętli łącza wodoru. Chociaż ta konfiguracja jest sterycznie możliwa, nigdy nie obserwowano jej w naturze.
Może ci służyć: Agar z dekstrozą: podkład, przygotowanie i użycieMożliwą przyczyną tego może być jego puste centrum, zbyt duże, aby umożliwić wydajność sił Van der Waalsa, które pomogłyby ustabilizować strukturę, i jednak jest zbyt mała, aby umożliwić przejście cząsteczek wody.
Struktura superscundaria
Struktury nadzorcze. Struktury te mogą wystąpić w wielu białkach kulistych. Istnieją różne możliwe kombinacje, z których każda ma szczególne cechy.
Niektóre przykłady struktur supersecundarias to: jednostka βαβ, w którym dwie równoległe arkusze β są połączone segmentem α śmigła; jednostka αα, charakteryzujący się dwoma kolejnymi αices, ale oddzielonymi przez segment nieheliczny, związany z kompatybilnością jego łańcuchów bocznych.
Kilka arkuszy β może się wycofać, dając konfigurację beczka β, podczas gdy arkusz Antipalala β wycofał Grecki klucz.
Bibliografia
- C.K. Mathews, k.I. Van Hold & K.G. Ahern (2002). Biochemery. 3. edycja. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, s. 1. Mayes, d.C. Granner i V.W. Rodwell (1996). Biochemeryka Harpera. Appleton i Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemery. 5. edycja. W. H. Freeman and Company.
- J.Koolman i k.-H. Roehm (2005). Atlas koloru biochemii. 2. edycja. Thieme.
- DO. Lehninger (1978). Biochemia. Omega Editions, S.DO.
- T. McKee i J.R. McKee (2003). Biochemia: molekularna podstawa życia. 3R & D Wydanie. McGraw-Hiii Companies, Inc.
- « Elastyczne wstrząsy w wymiarze, specjalne przypadki, ćwiczenia
- Bieżące charakterystyka wartości, wzory i przykłady »

