Lewis Structure to, z czego polega, jak się radzi, przykłady

- 2903
- 64
- Pani Waleria Marek
Struktura Lewisa To wszystko, co reprezentacja wiązań kowalencyjnych w cząsteczce lub jonie. W nim te wiązania i elektrony są reprezentowane z długimi punktami lub skryptami, chociaż przez większość czasu punkty odpowiadają nieistotnym elektronom i skryptom z wiązaniami kowalencyjnymi.
Ale co to jest kowalencyjne link? Jest to dzielenie się kilkoma elektronami (lub punktami) między dwoma atomami stolika okresowego. Za pomocą tych diagramów możesz naszkicować wiele szkieletów dla pewnego związku. Który z nich jest właściwy, będzie zależeć od formalnych obciążeń i chemicznej natury tych samych atomów.
 Związek 2-bromopropanu. Ben Million [domena publiczna], z Wikimedia Commons.
Związek 2-bromopropanu. Ben Million [domena publiczna], z Wikimedia Commons. Na lepszym obrazie istnieje przykład tego, czym jest struktura Lewisa. W tym przypadku reprezentowany związek to 2 bromopropano. Czarne punkty odpowiadające elektronom można zobaczyć, zarówno tych, którzy uczestniczą w linkach, jak i nie udostępniono (jedyny moment obrotowy tuż nad BR).
Gdyby punkty „:” zostały zastąpione długim skryptem „-”, wówczas szkielet węglowy 2-bromopropano byłby reprezentowany jako: C-C-C. Dlaczego zamiast narysowanej „ramy molekularnej”, czy może to być c-h-h-c-c? Odpowiedź leży w elektronicznych cechach każdego atomu.
Zatem, ponieważ wodór ma tylko jeden elektron i jeden orbital do wypełnienia, tylko wiązanie kowalencyjne. Dlatego nigdy nie możesz utworzyć dwóch wiązań (nie myl się z mostami wodorowymi). Z drugiej strony elektroniczna konfiguracja atomu węglowego pozwala (i wymaga) tworzenia czterech kowalencyjnych wiązań.
Z tego powodu struktury Lewisa, w których C i H muszą być spójne i szanować to, co rządzi ich konfiguracje elektroniczne. W ten sposób, jeśli węgiel ma więcej niż cztery wiązania lub wodór więcej niż jeden, wówczas szkic można wykluczyć i uruchomić nowy, zgodnie z rzeczywistością.
To tutaj pojawiają się niektóre z głównych przyczyn lub pleców tych struktur, wprowadzone przez Gilberta Newtona Lewisa w poszukiwaniu reprezentacji molekularnych wiernych danych eksperymentalnych: struktura molekularna i obciążenia formalne.
Wszystkie istniejące związki mogą być reprezentowane przez struktury Lewisa, co daje pierwsze podejście do tego, jak może być cząsteczka lub jony.
[TOC]
Co to jest struktura Lewisa?
Jest to reprezentatywna struktura elektronów Walencji i wiązań kowalencyjnych w cząsteczce lub jonie, która służy pojęciu jej struktury molekularnej.
Jednak ta struktura nie przewiduje niektórych ważnych szczegółów, takich jak geometria molekularna w odniesieniu do atomu i jego otoczenia (jeśli jest kwadratowy, płaski, dwupiramidowy itp.).
Nie mówi także nic o tym, czym jest hybrydyzacja chemiczna jego atomów, ale gdzie podwójne lub potrójne wiązania są umieszczane i jeśli w strukturze występuje rezonans.
Dzięki tym informacjom możesz spierać się o reaktywność związku, jego stabilność, jak i jaki mechanizm będzie podążył podczas reakcji.
Z tego powodu struktury Lewisa nigdy nie przestają być rozważane i są bardzo przydatne, ponieważ mogą skondensować nowe uczenie się chemiczne.
Jak to jest zrobione?
Aby narysować lub szkicować strukturę, wzór lub schemat Lewisa, niezbędny jest wzór chemiczny związku. Bez tego nie możesz nawet wiedzieć, jakie są atomy, które to wymyślą. Po nim, do zlokalizowania, które grupy należą.
Może ci służyć: lepkość: przykłady, przyczyny, jednostki, typyNa przykład, jeśli masz związek C14ALBO2N3 Wtedy musielibyśmy szukać grup, w których jest węgiel, tlen i azot. Zrobiłem to, niezależnie od związku, liczba elektronów walencyjnych pozostaje taka sama, więc wcześniej czy później zapamiętują.
Zatem węgiel należy do grupy VAT, tlen do grupy via i azot do VA. Liczba grupy jest równa ilości elektronów (punktów) Walencji. Wszystkie mają wspólną tendencję do uzupełniania oktetów warstwy Walencji.
Jaka jest reguła oktetu?
To mówi, że istnieje trend atomów, aby ukończyć poziom energii z ośmioma elektronami, aby osiągnąć stabilność. Dotyczy to wszystkich elementów innych niż metalowe lub znalezione w blokach S lub P w tabeli okresowej.
Jednak nie wszystkie elementy są przestrzegane przez zasadę oktetu. Poszczególnymi przypadkami są metale przejściowe, których struktury są bardziej oparte na obciążeniach formalnych i ich liczbie grupy.
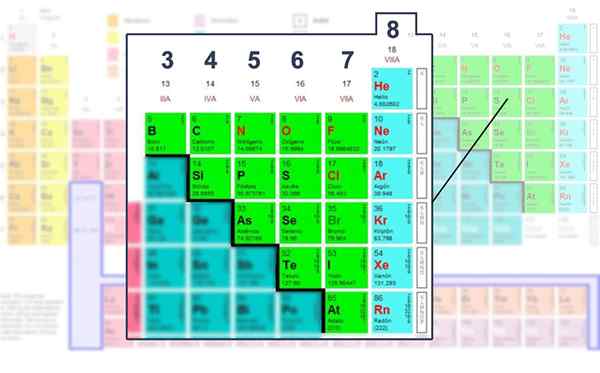 Liczba elektronów warstwy Walencji elementów nieeMetalicznych, w których można ją obsługiwać za pomocą struktury Lewisa.
Liczba elektronów warstwy Walencji elementów nieeMetalicznych, w których można ją obsługiwać za pomocą struktury Lewisa. Zastosowanie formuły matematycznej
Wiedząc, która grupa należą elementy, a zatem liczba dostępnych elektronów walencyjnych do tworzenia linków, wykonana jest następująca formuła, która jest przydatna do rysowania struktur Lewisa:
C = n - d
Gdzie C oznacza współdzielone elektrony, to znaczy ci, którzy uczestniczą w kowalencyjnych obligacjach. Ponieważ każdy link składa się z dwóch elektronów, c/2 jest równe liczbie linków (lub skryptów), które należy narysować.
N to niezbędne elektrony, Ci, którzy muszą mieć atom w warstwie Walencji, aby być izolektronicznym do szlachetnego gazu, który następuje w tym samym okresie. Dla wszystkich elementów innych niż H (ponieważ wymaga dwóch elektronów do porównania z nim) potrzebują ośmiu elektronów.
D są dostępne elektrony, które są określone przez grupy lub elektrony liczby walencji. Zatem, ponieważ CL należy do grupy VIIA, musi być otoczony siedmioma czarnymi lub elektronami i pamiętaj, że para jest potrzebna, aby utworzyć link.
Mając atomy, ich punkty i liczbę linków c/2, struktura Lewisa można następnie improwizować. Ale ponadto konieczne jest pojęcie innych „zasad”.
Gdzie umieścić mniej atomów elektroungatywnych
Mniej elektroonegatywne atomy w zdecydowanej większości struktur zajmują centra. Z tego powodu, jeśli masz związek z atomami P, O i F, P musi zatem znajdować się w środku struktury hipotetycznej.
Należy również podkreślić, że hydrogeny są zwykle powiązane z atomami bardzo elektrowni. Jeśli masz związek Zn, H i O, H pójdzie obok O, a nie z Zn (Zn-O-H i bez H-Zn-O). Istnieją wyjątki od tej reguły, ale zwykle występuje w przypadku atomów niemetalicznych.
Symetria i obciążenia formalne
Natura ma duże preferencje dla powodowania struktur molekularnych tak symetrycznych, jak to możliwe. Pomaga to uniknąć podnoszenia nieuporządkowanych struktur, a atomy ułożone w taki sposób, że nie są posłuszne jak żaden widoczny wzór.
Może ci służyć: teorie kwasowo-basowe: Arrhenius, Bronsted-Lowry, LewisNa przykład dla związku C2DO3, Gdzie A jest atomem fikcyjnym, najbardziej prawdopodobną strukturą byłaby A-C-A-C-A. Zwróć uwagę na symetrię ich boków, obie odbicia drugiego.
Obciążenia formalne odgrywają również ważną rolę podczas rysowania struktur Lewisa, szczególnie w przypadku jonów. Zatem łącza można dodać lub usunąć, aby formalne obciążenie atomu odpowiadało całkowite wyświetlone obciążenie. To kryterium jest bardzo pomocne w przypadku związków metali przejściowych.
Ograniczenia w regule Otret
 Reprezentacja trifluorku aluminiowego, niestabilny związek. Oba elementy składają się z sześciu elektronów, które generują trzy wiązania kowalencyjne, gdy powinny mieć osiem, aby osiągnąć stabilność. Źródło: Gabriel Bolívar
Reprezentacja trifluorku aluminiowego, niestabilny związek. Oba elementy składają się z sześciu elektronów, które generują trzy wiązania kowalencyjne, gdy powinny mieć osiem, aby osiągnąć stabilność. Źródło: Gabriel Bolívar Nie wszystkie reguły są spełnione, co niekoniecznie oznacza, że struktura jest nieprawidłowa. Typowe przykłady tego są obserwowane w wielu związkach, w których zaangażowane są pierwiastki grupy IIIA (B, Al, Ga, IN, TL). Tutaj jest szczególnie uważane za aluminiowe trifluoruro (alf3).
Następnie stosując formułę opisaną powyżej, masz:
D = 1 × 3 (atom aluminiowy) + 7 × 3 (trzy atomy fluorowe) = 24 elektrony
Tutaj 3 i 7 są odpowiednie grupy lub liczba elektronów walencyjnych dostępnych dla aluminium i fluoru. Następnie, biorąc pod uwagę niezbędne elektrony n:
N = 8 × 1 (atom aluminiowy) + 8 × 3 (trzy atomy fluorowe) = 32 elektrony
I dlatego wspólne elektrony to:
C = n - d
C = 32 - 24 = 8 elektronów
C/2 = 4 linki
Ponieważ aluminium jest najmniej elektroungatywnym atomem, musi być umieszczone na środku, a fluor tworzy tylko ogniwo. Biorąc to pod uwagę, masz strukturę Lewis del Alf3 (obraz górny). Wspólne elektrony są wyróżnione zielonymi punktami, aby odróżnić je od zniszczonych.
Chociaż obliczenia przewidują, że należy utworzyć 4 linki, aluminium nie ma wystarczającej ilości elektronów, a także nie ma czwartego atomu fluoru. W rezultacie aluminium nie jest zgodne z zasadą oktetu i fakt ten nie znajduje odzwierciedlenia w obliczeniach.
Przykłady struktury Lewisa
Jod
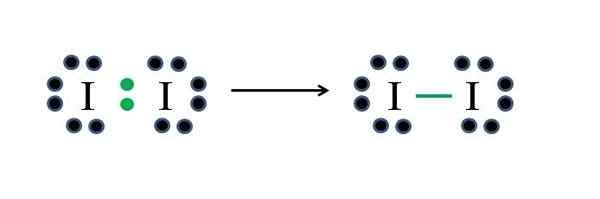 Iodo non -metal ma siedem elektronów, więc dzieląc jeden z tych elektronów, generują kowalencyjne wiązanie, które daje im stabilność. Źródło: Gabriel Bolívar
Iodo non -metal ma siedem elektronów, więc dzieląc jeden z tych elektronów, generują kowalencyjne wiązanie, które daje im stabilność. Źródło: Gabriel Bolívar Jod jest halogenem i dlatego należy do grupy VIIA. Ma następnie siedem elektronów walencji, a tę prostą cząsteczkę okrzemkową można reprezentować improwizowanie lub stosowanie wzoru:
D = 2 × 7 (dwa atomy jodu) = 14 elektronów
N = 2 × 8 = 16 elektronów
C = 16 - 14 = 2 elektrony
C/2 = 1 link
Ponieważ 14 elektronów 2 uczestniczy w kowalencyjnej więzi (zielone punkty i skrypt), 12 pozostaje jako nie udostępniane; A ponieważ są to dwa atomy jodu, 6 musi być rozmieszczone dla jednego z nich (ich elektrony walencyjne). W tej cząsteczce możliwa jest tylko ta struktura, której geometria jest liniowa.
Amoniak
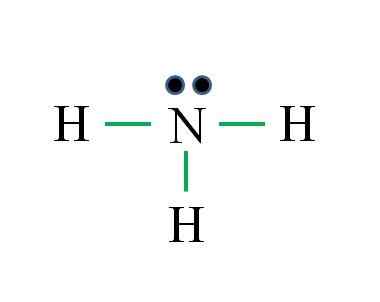 Azot ma 5 elektronów, podczas gdy wodór tylko 1. Wystarczające, aby osiągnąć stabilność, gdy ustalone są trzy wiązania kowalencyjne, złożone z elektronu N i innego źródła H: Gabriel Bolívar
Azot ma 5 elektronów, podczas gdy wodór tylko 1. Wystarczające, aby osiągnąć stabilność, gdy ustalone są trzy wiązania kowalencyjne, złożone z elektronu N i innego źródła H: Gabriel Bolívar Jaka jest struktura Lewisa dla cząsteczki amoniaku? Ponieważ azot pochodzi z grupy VA, ma pięć elektronów walencji, a następnie:
Może ci służyć: termometr laboratoryjny: Charakterystyka, do czego służy, przykładyD = 1 × 5 (atom azotowy) + 1 × 3 (trzy atomy wodoru) = 8 elektronów
N = 8 × 1 + 2 × 3 = 14 elektronów
C = 14 - 8 = 6 elektronów
C/2 = 3 linki
Tym razem formuła jest odpowiednia z liczbą linków (trzy zielone linki). Według 8 dostępnych elektronów 6 uczestniczy w wiązaniach, nad momentem azotowym znajduje się moment obrotowy nieudany.
Ta struktura mówi wszystko, co powinno być znane z bazy amoniaku. Stosując wiedzę TEV i TRPEV, wynika z tego, że geometria jest czworościenna zniekształcona przez wolny moment obrotowy azotu i że hybrydyzacja tego jest zatem3.
C2H6ALBO
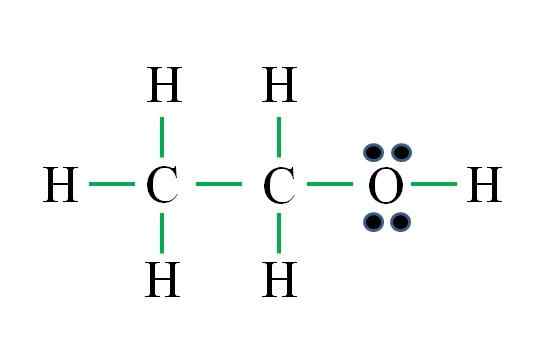 Źródło: Gabriel Bolívar
Źródło: Gabriel Bolívar Wzór odpowiada związku organicznego. Przed zastosowaniem wzoru należy pamiętać, że hydrogeny tworzą pojedyncze wiązanie, tlen dwa, węgiel cztery i że struktura musi być tak symetryczna, jak to możliwe. Postępowanie jako poprzednie przykłady to:
D = 6 × 1 (sześć atomów wodoru) + 6 × 1 (atom tlenu) + 4 × 2 (dwa atomy węgla) = 20 elektronów
N = 6 × 2 (sześć atomów wodoru) + 8 × 1 (atom tlenu) + 8 × 2 (dwa atomy węgla) = 36 elektronów
C = 36 - 20 = 16 elektronów
C/2 = 8 linków
Liczba zielonych skryptów odpowiada 8 obliczonym łączom. Proponowana struktura Lewisa to etanol ch3Ch2Oh. Byłoby jednak również prawidłowe zaproponowanie struktury eteru dimetylowego3Och3, który jest jeszcze bardziej symetryczny.
Który z nich jest „bardziej” prawidłowy? Oba są jednakowo, ponieważ struktury powstały jako izomery strukturalne o tym samym wzorze molekularnym C2H6ALBO.
Jon permanganate
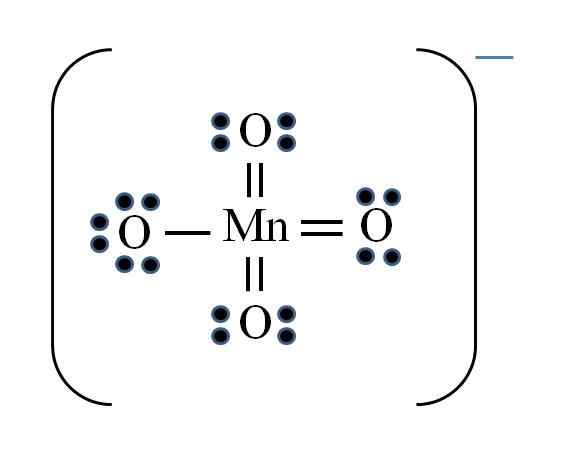 Źródło: Gabriel Bolívar
Źródło: Gabriel Bolívar Sytuacja jest skomplikowana, gdy chcesz robić struktury Lewisa dla związków metali przejściowych. Mangan należy do grupy VIIB, a także elektron obciążenia ujemnego musi być dodany wśród dostępnych elektronów. Stosując posiadaną formułę:
D = 7 × 1 (atom manganu) + 6 × 4 (cztery atomy tlenu) + 1 elektron na obciążenie = 32 elektrony
N = 8 × 1 + 8 × 4 = 40 elektronów
C = 40 - 32 = 8 wspólnych elektronów
C/2 = 4 linki
Jednak metale przejściowe mogą mieć więcej niż osiem elektronów w Walencji. Również dla MNO Ion4- Wykazuje obciążenie ujemne, konieczne jest zmniejszenie formalnych obciążeń atomów tlenu. Jak? Za pośrednictwem podwójnych linków.
Jeśli wszystkie linki MNO4- Były proste, formalne obciążenia tlenu byłyby równe -1. Ponieważ są cztery, wynikowe obciążenie wynosiłoby -4 dla anionu, co oczywiście nie jest prawdą. Po utworzeniu podwójnych wiązań, gwarantowane jest, że pojedynczy tlen ma ujemne obciążenie formalne, odzwierciedlone w jonie.
W jonie permanganate można zauważyć, że istnieje rezonans. Oznacza to, że jedyny prosty łącze Mn-O jest demokalizowane między czterema atomami O.
Jon dicromato
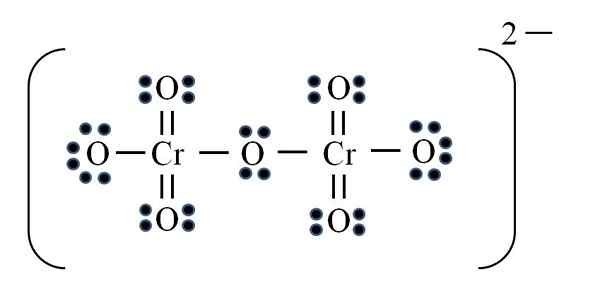 Źródło: Gabriel Bolívar
Źródło: Gabriel Bolívar Wreszcie podobny przypadek występuje z jonem Dicromato (Cr2ALBO7). Chrom należy do grupy vib, więc ma sześć elektronów walencji. Ponownie zastosowanie formuły:
D = 6 × 2 (dwa atomy chromowe) + 6 × 7 (siedem atomów tlenu) + 2 elektrony przez obciążenie dwuwartościowe = 56 elektronów
N = 8 × 2 + 8 × 7 = 72 elektrony
C = 72 - 56 = 16 wspólnych elektronów
C/2 = 8 linków
Ale nie ma 8 linków, ale 12. Z tych samych powodów stwierdzonych w jonie permanganinianowym dwa tlenie muszą pozostawić ujemne obciążenia formalne, które dodają równe -2, obciążenie jonu dicromato.
Zatem dodaje się tyle podwójnych linków, jak to konieczne. W ten sposób osiągasz strukturę Lewisa obrazu dla CR2ALBO72-.
Bibliografia
- Whitten, Davis, Peck i Stanley. Chemia. (8 wyd.). Cengage Learning, s. 251.
- Struktury Lewisa. Zaczerpnięte z: chemiczne.Chem.Purdue.Edu
- Steven a. Hardinger, Department of Chemistry & Biochemistry, UCLA. (2017). Struktura Lewisa. Zaczerpnięte z: chem.UCLA.Edu
- Wayne Breslyn. (2012). Rysowanie struktur Lewisa. Zaczerpnięte z: terpconnect.Umd.Edu
- Webmaster. (2012). Struktury Lewis („DOT Electron”). Department of Chemistry, University of Maine, Orono. Zaczerpnięte z: chemii.Umeche.Maine.Edu
- Lancaster, Sean. (25 kwietnia 2017 r.). Jak ustalić, ile kropek znajduje się w strukturze kropki Lewisa. Naukowe. Odzyskane z: naukowe.com

