Czwartorzędowa struktura białek charakterystycznych

- 3875
- 830
- Filip Augustyn
Struktura czwartorzędowa białek definiuje relacje przestrzenne między każdą z jego podjednostek polipeptydów połączonych przez siły niekowalencyjne. W białkach polimerowych każda z łańcuchów polipeptydowych, które je tworzą.
Białka mogą być tworzone przez jeden (monomeryczny), dwa (dimérica), kilka (oligomeryczne) lub wiele protomerów (polimerowe). Te protomery mogą mieć między nimi podobną lub bardzo różną strukturę molekularną. W pierwszym przypadku mówi się, że są to białka homotypowe, aw drugim przypadku heterotypowe.
 Przykład czwartorzędowej struktury białka antygenowego komórki proliferacyjnej. Zrobione i zredagowane z: Thomas Shafee [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)].
Przykład czwartorzędowej struktury białka antygenowego komórki proliferacyjnej. Zrobione i zredagowane z: Thomas Shafee [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)]. W notacji naukowej biochemicy używają greckich liter z indeksami dolnymi do opisania składu protomerów białkowych. Na przykład tetrameryczne białko homotypowe jest oznaczone jako α4, Podczas gdy białko tetrameryczne utworzone przez dwa różne dimery jest oznaczone jako α2β2.
[TOC]
Struktura białka
Białka to złożone cząsteczki, które nabywają różne trzy wymiarowe konfiguracje. Te konfiguracje są wyłączne dla każdego białka i pozwalają im wykonywać bardzo określone funkcje. Poziomy strukturalnej organizacji białek są następujące.
Struktura pierwotna
Odnosi się do sekwencji, w której rozmieszczone są różne aminokwasy w łańcuchu polipeptydowym. Ta sekwencja podaje sekwencja DNA, która koduje takie białko.
Struktura wtórna
Większość białek nie ma długich łańcuchów całkowicie rozszerzonych aminokwasów, ale mają regiony, które są regularnie składane w postaci śmigieł lub arkuszy. To składanie jest tym, które nazywa się strukturą wtórną.
Struktura trzeciorzędowa
Złożone obszary struktury wtórnej mogą z kolei złożyć i złożyć w bardziej zwartych strukturach. Ten ostatni fałd jest tym, który nadaje białku jego trójwymiarową postać.
Struktura czwartorzędowa
W białkach utworzonych przez więcej niż jedną podjednostkę, struktury czwartorzędowe to relacje przestrzenne, które istnieją między każdą podjednostką, które są powiązane przez wiązania niekowalencyjne.
Może ci służyć: jak oddychaj grzybami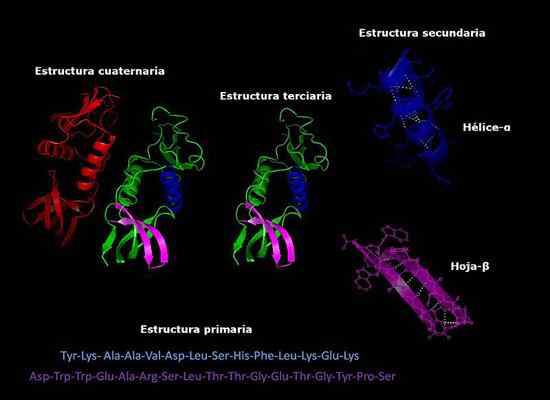 Pierwotne, wtórne, trzeciorzędowe i czwartorzędowe struktury białek, trójwymiarowa konformacja. Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Pierwotne, wtórne, trzeciorzędowe i czwartorzędowe struktury białek, trójwymiarowa konformacja. Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Stabilność struktury czwartorzędowej
Trzy -wymiarowa struktura białek jest stabilizowana przez słabe lub niekowalencyjne interakcje. Chociaż te łącza lub interakcje są znacznie słabsze niż normalne kowalencyjne wiązania, są one liczne, a ich skumulowany efekt jest silny. Następnie zobaczymy jedne z najczęstszych interakcji.
Interakcje hydrofobowe
Niektóre aminokwasy zawierają hydrofobowe łańcuchy boczne. Kiedy białka posiadają te aminokwasy, fałdowanie cząsteczki zamawia te boczne łańcuchy w białko i chroni przed wodą. Charakter różnych łańcuchów bocznych powoduje, że przyczyniają się one na różne sposoby w efekcie hydrofobowym.
Interakcje van der waals
Te interakcje występują, gdy cząsteczki lub atomy, które nie są zjednoczone przez kowalencyjne wiązania, zbliżają się do nich zbyt wiele między nimi, a z tego powodu ich najbardziej zewnętrzne orbitale elektroniczne zaczynają się nakładać.
W tym czasie ustanawiana jest siła odpychania między tymi atomami, które rosną bardzo szybko, gdy ich odpowiednie centra przybliżają. Są to „siły” Van der Waals.
Interakcje obciążenia
Jest to interakcja elektrostatyczna, która występuje między kilkoma obciążonymi cząstkami. W białkach występuje ten rodzaj interakcji, zarówno ze względu na ładunek elektryczny netto białka, jak i indywidualne obciążenie jonów zawartych w środku. Ten rodzaj interakcji jest czasami nazywany Puente Salino.
Wiązania wodorowe
Wiązanie wodorowe jest ustalane między przyłączonym atomem wodoru za pomocą środków.
Ten rodzaj wiązania jest bardzo ważny, ponieważ właściwości wielu cząsteczek, w tym właściwości wody i cząsteczek biologicznych, są głównie spowodowane wiązaniami wodorowymi. Nieruchomości akcji wiązań kowalencyjnych (elektrony są dzielone), a także interakcji nie-stowarzyszonych (interakcja obciążenia ładunkiem).
Może ci służyć: przejściowe uprawyInterakcje Dipolos
W cząsteczkach, w tym białka, które nie przedstawiają obciążenia netto, można przesłać nierównomierne rozmieszczenie ich wewnętrznych obciążeń, z nieco bardziej ujemnym końcem niż inny. To jest znane jako dipol.
Ten stan dipolowy cząsteczki może być trwały, ale można go również indukować. Dipolos można przyciągnąć do jonów lub innych dipoli. Jeśli dipole są trwałe, interakcja ma większy zakres niż jest przedstawiony z indukowanymi dipolami.
Oprócz tych niekowalencyjnych interakcji, niektóre białka oligomeryczne stabilizują ich strukturę czwartorzędową za pomocą kowalencyjnego typu łącza, łącza disiarczkowego. Są one ustalone między grupami sulfodhydrillo cysteonów różnych protomerów.
Wiązania disulfuro pomagają również ustabilizować wtórną strukturę białek, ale w tym przypadku odpady cysteiny łączą się w tym samym polipeptydie (łącza disiarczkowe intrapopolipeptydowe).
Interakcje między protomeresami
Jak wspomniano wcześniej, w białkach składających się z kilku podjednostek lub protomerów, podjednostki te mogą być podobne (homotypowe) lub różne (heterotypowe).
Interakcje homotypowe
Podjednostki tworzące białko to asymetryczne łańcuchy polipeptydowe. Jednak w interakcjach homotypowych podjednostki te można powiązać na różne sposoby, osiągając różne rodzaje symetrii.
Grupy, które oddziałują z każdym protomerem, znajdują się na ogół w różnych pozycjach, więc nazywane są interakcjami heterologicznymi. Heterologiczne interakcje między różnymi podjednostkami, czasami występują w taki sposób, że każda podjednostka jest krzywa w odniesieniu do precedensu, można osiągnąć spiralną strukturę i strukturę spiralną.
W innych przypadkach interakcje są podawane w taki sposób, że zdefiniowane grupy podjednostek są rozmieszczone wokół jednej lub kilku osi symetrii, w tak zwanej symetrii grupy punktowej. Gdy istnieje kilka osi symetrii, każda podjednostka zepsuta w odniesieniu do sąsiada 360 °/N (gdzie n reprezentuje liczbę osi).
Może ci służyć: australijska flora i fauna: reprezentatywne gatunkiWśród rodzajów symetrii, które są uzyskane w ten sposób, są na przykład helika.
Kiedy dwa podjednostki oddziałują przez osi binarną, każda jednostka zepsuła 180 ° w odniesieniu do drugiej, wokół tej osi. Ta symetria jest znana jako symetria C2. W nim miejsca interakcji w każdej podjednostce są identyczne; W takim przypadku nie można mówić o interakcji heterologa, ale o interakcji izologicznej.
Jeśli wręcz przeciwnie, powiązanie między dwoma składnikami dimera jest heterologiem, wówczas uzyskano asymetryczny dimer.
Interakcje heterotypowe
Nie zawsze podjednostki, które oddziałują w białku, mają ten sam charakter. Istnieją białka, które są tworzone przez dwanaście lub więcej różnych podjednostek.
Interakcje, które utrzymują stabilność białka, są takie same jak w interakcjach homotypowych, ale ogólnie uzyskuje się całkowicie asymetryczne cząsteczki.
Na przykład hemoglobina jest testerem, który przedstawia dwie pary różnych podjednostek (α2β2).
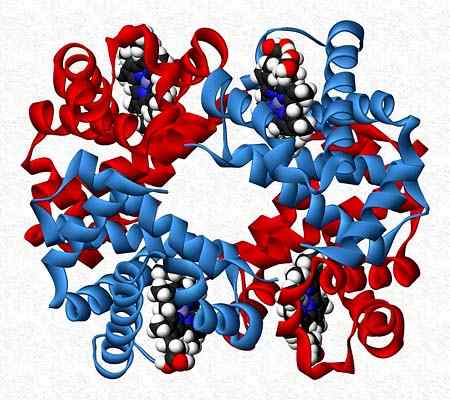 Czwartorzędowa struktura hemoglobiny. Zrobione i zredagowane z: Benjah-BMM27. Zmodyfikowany przez Alejandro Porto. [CC0].
Czwartorzędowa struktura hemoglobiny. Zrobione i zredagowane z: Benjah-BMM27. Zmodyfikowany przez Alejandro Porto. [CC0]. Bibliografia
- C.K. Mathews, k.I. Van Hold & K.G. Ahern (2002). Biochemery. 3. edycja. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, s. 1. Mayes, d.C. Granner i V.W. Rodwell (1996). Biochemeryka Harpera. Appleton i Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemery. 5. edycja. W. H. Freeman and Company.
- J. Koolman i k.-H. Roehm (2005). Atlas koloru biochemii. 2. edycja. Thieme.
- DO. Lehninger (1978). Biochemia. Omega Editions, S.DO.
- L. Stryer (1995). Biochemery. W.H. Freeman and Company, Nowy Jork.
- « XIX wiek w populacji Chile, społeczeństwo, gospodarka i polityka
- Charakterystyka, struktura, funkcje i zastosowania wimentyny »

