Właściwości skali mikroskopowej, zliczanie cząstek, przykłady
- 3024
- 646
- Filip Augustyn
Skala mikroskopowa Jest to taki, który służy do pomiaru rozmiarów i długości, których nie można zobaczyć gołym okiem i które znajdują się poniżej milimetra. Od wyższych do najniższych skal mikroskopowych w układzie metrycznym to:
- Milimetr (1 mm), który jest dziesiątą centymetra lub tysiąc. W tym skali mamy jedną z największych komórek w ciele, czyli jaję, której rozmiar wynosi 1,5 mm.
 Rysunek 1. Czerwone krwinki to mikroskopijne komórki. Źródło: Pixabay
Rysunek 1. Czerwone krwinki to mikroskopijne komórki. Źródło: Pixabay - Dziesiąta milimetr (0,1 mm). To jest skala grubości lub średnicy ludzkich włosów.
- Mikrometr lub MICRA (1 μm = 0,001 mm). W tej skali znajdują się komórki roślinne i zwierzęce i bakterie.
Komórki roślinne są rzędu 100 μm. Komórki zwierzęce są dziesięciokrotnie mniejsze, ma rzędu 10 μm; Podczas gdy bakterie są 10 razy mniej niż komórki zwierzęce i są rzędu 1 μm.
[TOC]
Skala nanometryczna
Istnieją nawet mniejsze pomiary niż skala mikroskopowa, ale nie są zwykle używane, z wyjątkiem niektórych specjalnych kontekstów. Następnie zobaczymy niektóre z najważniejszych miar nanometrycznych:
- Nanometr (1 ηm = 0,001 μm = 0,000001 mm) to milionowy milimetr. W tej skali są niektóre wirusy i cząsteczki. Wirusy są rzędu 10ηm i cząsteczek rzędu 1ηm.
- Angstrom (1å = 0,1ηm = 0,0001 μm = 10-7mm). Miara ta tworzy skalę lub rozmiar atomowy.
- Fantometr (1FM = 0,00001Å = 0,000001ηm = 10-12mm). Jest to skala jąder atomowych, które są od 10 tysięcy do 100 tysięcy razy mniejsze niż atom. Jednak pomimo jego niewielkiej wielkości, jądro koncentruje się 99,99% masy atomowej.
- Istnieją skale mniejsze do jądra atomowego, ponieważ składają się z cząstek, takich jak protony i neutrony. Ale jest ich więcej: te cząstki są z kolei tworzące bardziej podstawowe cząstki, takie jak kwarki.
Instrumenty do obserwacji mikroskopowej
Gdy obiekty znajdują się między milimetrową a skalą mikrometryczną (1 mm - 0,001 mm), można je zaobserwować za pomocą mikroskopu optycznego.
Jeśli jednak obiekty lub struktury znajdują się między nanometrów a angstrom, wówczas wymagane będą mikroskopy elektroniczne lub nanoskopowe.
W mikroskopii elektronicznej zamiast światła stosuje się elektrony o wysokiej energii, które mają znacznie niższą długość fali niż światło. Wadą mikroskopu elektronicznego jest to, że nie jest to możliwe.
Może ci służyć: szok magnetyczny: jednostki, wzory, obliczenia, przykładyZ drugiej strony światło laserowe jest używane w nanoskopie i ma tę zaletę nad mikroskopią elektroniczną, że struktury i cząsteczki mogą być sprawdzane i rejestrowane w żywej komórce.
Nanotechnologia to technologia, z którą obwody, struktury, części, a nawet silniki są wytwarzane na skalach, od nanometru do skali atomowej.
Właściwości mikroskopowe
W fizyce, w pierwszym podejściu zachowanie materii i systemów jest badane z makroskopowego punktu widzenia. Z tego paradygmatu sprawa jest nieskończenie podzielną kontinuum; I ten punkt widzenia jest ważny i odpowiedni dla wielu sytuacji codziennego życia.
Jednak niektóre zjawiska świata makroskopowego mają tylko wyjaśnienie, czy weźmie się pod uwagę właściwości mikroskopowe sprawy.
W mikroskopijnym punkcie widzenia uwzględniono strukturę molekularną i atomową materii. W przeciwieństwie do makroskopowego podejścia, na tej skali istnieje ziarnista struktura z otworami i przestrzeniami między cząsteczkami, atomami, a nawet w tych.
Inną cechą mikroskopijnego punktu widzenia w fizyce jest to, że kawałek materii bez względu na to, jak mały, składa się z ogromnej liczby cząstek oddzielonych od siebie i w ciągłym ruchu.
-Materia to ogromna pustka
W małym ciasto.
Oznacza to, że kawałek materii w skali mikroskopowej jest ogromną pustką ze stężeniami atomów i jąder, które zajmują bardzo niewielką część całkowitej objętości. W tym sensie skala mikroskopowa ma podobieństwo do skali astronomicznej.
Obiektów makroskopowych do odkrycia atomu
Pierwsze chemikalia, które były alchemiści, zdały sobie sprawę, że materiały mogą być dwóch typów: czyste lub związki. To osiągnęło ideę pierwiastków chemicznych.
Może ci służyć: gradient ciśnienia: co to jest i jak jest obliczanePierwsze odkryte elementy chemiczne to siedem metali starożytności: srebro, złoto, żelazo, ołów, cyna, miedź i rtęć. Z czasem zostały odkryte bardziej do tego stopnia, że znaleziono substancje, które nie mogły rozbić w innych.
Następnie elementy zostały sklasyfikowane zgodnie z ich właściwościami i cechami w metalach i niemetalach. Wszyscy, którzy mieli podobne właściwości chemiczne i powinowactwo.
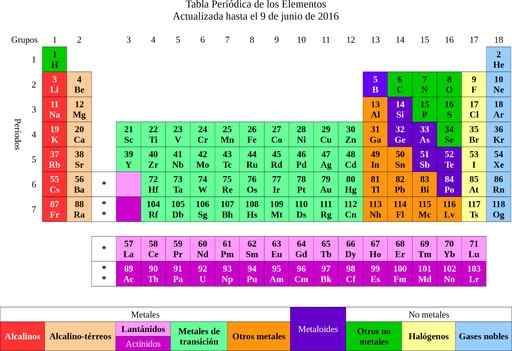 Rysunek 2. Okresowa tabela elementów. Źródło: Wikimedia Commons.
Rysunek 2. Okresowa tabela elementów. Źródło: Wikimedia Commons. Od elementów poszło na pomysł atomów, słowo, które oznacza niepodzielny. Niedługo później naukowcy zauważyli, że atomy miały strukturę. Ponadto atomy miały dwa rodzaje ładunku elektrycznego (dodatnie i ujemne).
Cząstki subatomiczne
W eksperymentach Rutherforda, w których zbombardował atomy cienkiej złotej płyty cząstkami alfa, ujawniono strukturę atomu: małe dodatnie jądro otoczone elektronami.
Nadal bombardowali atomy coraz większej liczby cząstek energii i nadal są wykonywane, aby coraz częściej rozwiązywać tajemnice i właściwości mikroskopowego świata.
W ten sposób osiągnięto standardowy model, który stwierdza, że prawdziwe elementarne cząstki są polegającymi na składaniu atomów. Z kolei atomy powodują powstanie pierwiastków, one na związki i wszystkie znane interakcje (z wyjątkiem grawitacji). W sumie jest 12 cząstek.
Te podstawowe cząstki mają również okres okresowy. Istnieją dwie grupy: cząsteczki fermioniczne spin ½ i bosoniczne. Bosonic są odpowiedzialne za interakcje. Fermionika to 12 i są tymi, które powodują powstanie protonów, neutronów i atomów.
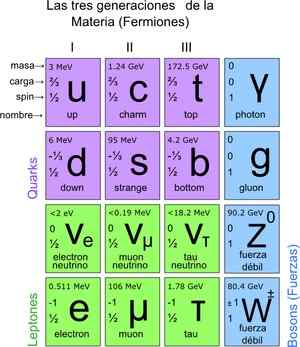 Rysunek 3. Podstawowe cząstki. Źródło: Wikimedia Commons.
Rysunek 3. Podstawowe cząstki. Źródło: Wikimedia Commons. Jak zliczyć cząstki w skali mikroskopowej?
Z czasem chemicy odkryli względne masy pierwiastków z precyzyjnych pomiarów w reakcjach chemicznych. Na przykład można ustalić, że węgiel jest 12 razy cięższy niż wodór.
Ustalono również, że wodór jest najlżejszym elementem, więc ten element przypisano masę względną 1.
Z drugiej strony chemikalia wymagane do poznania liczby cząstek zaangażowanych w reakcję, tak że żaden z nich nie brakuje. Na przykład cząsteczka wody wymaga dwóch atomów wodoru i jednego tlenu.
Może ci służyć: pofalowane zjawiskaZ tych tła rodzi się koncepcja mol. Jedna mol dowolnej substancji to stała ilość cząstek równoważna jej masie cząsteczkowej lub atomowej w gramach. W ten sposób ustalono, że 12 gramów węgla ma taką samą liczbę cząstek jak 1 gram wodoru. Liczba ta jest znana jako liczba Avogadro: 6,02 x 10^23 cząsteczki.
-Przykład 1
Oblicz, ile złotych atomów jest w 1 gramie złota.
Rozwiązanie
Wiadomo, że złoto ma masę atomową 197. Dane te można znaleźć w tabeli okresowej i wskazują, że złoty atom jest 197 razy cięższy niż jeden z wodoru i 197/12 = 16 416 razy cięższy niż węgiel.
Złoty mol ma atomy 6,02 × 10^23 i ma masę atomową wyrażoną w gramach, to znaczy 197 gramów.
W gramu złota znajduje się 1/197 moli złota, czyli 6,02 × 10^23átomos/197 = 3,06 x10^23 Złoto.
-Przykład 2
Określ liczbę cząsteczek węglanu wapnia (CACO3) że istnieje w 150 gramach tej substancji. Powiedz także, ile atomów wapnia, ile węgla i ile tlenu jest w tym związku.
Rozwiązanie
Pierwszą rzeczą jest określenie masy cząsteczkowej węglanu wapnia. Okresowa tabela wskazuje, że wapń ma masę cząsteczkową 40 g/mol, węgiel 12 g/mol i tlen 16 g/mol.
Następnie masa cząsteczkowa (Caco3) Być :
40 g/mol + 12 g/mol + 3 x 16 g/mol = 100 g/mol
Co 100 gramów węglanu wapnia wynosi 1mol. Następnie w 150 gramach odpowiada 1,5 moli.
Każdy mol węglanu ma cząsteczki węglanu 6,02 x 10^23, więc w 1,5 mole węglanu jest 9,03 x 10^23 cząsteczek.
Podsumowanie, w 150 gramach węglanu wapnia jest:
- 9,03 x 10^23 Cząsteczki węglanu wapnia.
- Atomy wapnia: 9,03 x 10^23 .
- Także 9,03 x 10^23 atomy węgla
- Wreszcie, 3 x 9,03 x 10^23 atomy tlenu = 27,09 x 10^23 Atomy tlenu.
Bibliografia
- Biologia stosowana. Jakie są miary mikroskopowe?. Odzyskane z: YouTube.com
- Edukacja chemiczna. Makroskopowe, submikroskopowe i symboliczne przedstawienia w materii. Odzyskany z: Scielo.org.MX.
- Garcia a. Interaktywny kurs fizyki. Makro -state, mikrostan. Temperatura, entropia. Źródło: SC.Ehu.Jest
- Mikroskopowa struktura materii. Odzyskane z: alipso.com
- Wikipedia. Poziom mikroskopowy. Odzyskane z: Wikipedia.com

