Skala Pauling

- 2398
- 733
- Gabriela Łuczak
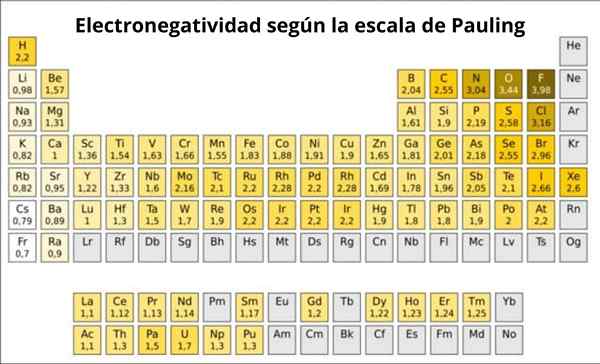 Rysunek 1. Skala Pauling. Źródło: Wikimedia Commons.
Rysunek 1. Skala Pauling. Źródło: Wikimedia Commons. Jaka jest skala Pauling?
Skala Pauling Jest to arbitralna skala stosowana w chemii do wyrażenia Elektronialiczność elementów. Jest to definiowane jako tendencja pewnego atomu do przyciągania elektronów w połączeniu z innym atomem.
W tym sensie elementy o wysokiej elektroonetronegatyczności mają tendencję do łatwego zysku elektrony. Są to nie -metale, podczas gdy ze swojej części, mniej elektroonywatywne elementy, takie jak metale, łatwiej jest im wytworzyć elektrony.
Dlatego znajomość elektroonywentności elementu ma pojęcie o rodzaju łącza, które jest zdolne do tworzenia się w połączeniu z innym. Później zobaczymy to z przykładem numerycznym.
Dzięki tym informacjom możesz przewidzieć wiele właściwości, które będzie miał związek, coś bardzo przydatnego w chemii eksperymentalnej i dla nauki o materiałach, w których stale tworzone są nowe związki.
Jednak wygodne jest wyjaśnienie, że pomimo tego, jak ważne jest, nie ma unikalnego sposobu określenia elektroungalizacji; Skala Pauling jest tylko jedną z różnych form zaproponowanych do jej znalezienia, chociaż jest jednym z najczęściej używanych.
W rzeczywistości Paulinga jest arbitralną skalą, w której wartość numeryczna jest przypisywana do każdego elementu tabeli okresowej, co odzwierciedla jego elektrooniczność. Widzimy to na rycinie 1, gdzie masz elektroonywatywność każdego elementu, jak przypisano dwukrotnie nagrodę Nobla Linusa Paulinga (1901–1994) około 1939 r.
Elektrocjalność pierwiastków
Pauling, obok Don M. YOST, stwierdził empirycznie wartości elektroonegatywności poprzez dane eksperymentalne uzyskane przez pomiar energii łącza.
Pauling przydzielony do fluorowej.0. Tak więc, gdy fluorowy tworzy połączenia, wykazuje najwyższy trend przyciągania elektronów spośród wszystkich pierwiastków.
Może ci służyć: numer koordynacyjny: co to jest, obliczenia, przykładyDrugi to tlen z 3.5 i trzeci to azot z 3.0. Oba znajdują się powyżej i po prawej stronie tabeli.
Z drugiej strony, na drugim końcu, najmniejszy element elektrounglacyjny jest cez, którego symbol jest CS, znajdujący się po lewej stronie stołu, który Pauling przypisał numer 0.7.
Elektronialiczność w stole okresowym
Ogólnie i jak zaobserwowano na rycinie 1, energia elektroonegatywności i jonizacji - wzrasta od lewej do prawej w stole okresowym. Ogólny trend wskazuje również na spadek podczas przechodzenia od góry do dołu.
Dlatego najbardziej elektroonywentne pierwiastki będą miały je w górnym kątu stolika: fluor, tlen, chlor, azot. Najmniej elektronegatywne -lub najbardziej elektropozytywne, jeśli są one preferowane -będzie po lewej: lit, sód, potas i inne elementy grupy 1 -kolumna skrajnej lewicy, odpowiadająca metali alkalicznych i alkalicznych-.
W każdej kolumnie elektronegatywność zmniejsza się poprzez zwiększenie liczby atomowej elementu, z wyjątkiem metali przejściowych w środku, które nie są zgodne z tym trendem.
Ważną kwestią, którą należy podkreślić, jest to, że elektroonyczność jest względna, nie jest to nieokreślona właściwość każdego elementu i jest mierzona tylko w odniesieniu do innych elementów. Zależy to wiele od stanu utleniania, więc ten sam element może wykazywać inną elektrooniczność, w zależności od rodzaju tworzenia się związku.
Połącz różnicę energii
 Rysunek 2. Amerykański chemik Linus Pauling w 1955 roku. Źródło: Wikimedia Commons.
Rysunek 2. Amerykański chemik Linus Pauling w 1955 roku. Źródło: Wikimedia Commons. W chemii link to sposób, w jaki atomy są łączone, tak samo lub różne, tworząc cząsteczki. Wśród atomów są siły, które utrzymują je razem stabilne.
Istnieje kilka rodzajów linków, ale dwa są tutaj rozważane:
- Kowalencyjny, w których atomy podobnych elektroungatityzacji dzielą kilka elektronów.
- joński, częste między atomami o różnych elektrowni, w których panuje przyciąganie elektrostatyczne.
Załóżmy, że dwa pierwiastki A E B mogą tworzyć ze sobą cząsteczki, oznaczały AA i BB. I są również w stanie dołączyć, aby utworzyć związek AB, cały rodzaj linku.
Dzięki udziałowi sił międzycząsteczkowych w linku jest energia. Na przykład energia w linku AA to EAa, W linku BB jest odpływy, a wreszcie w związku AB jest EAb.
Jeśli cząsteczka AB zostanie utworzona przez kowalencyjne wiązanie, teoretycznie energia łącza jest średnią energii iAa i enocleg ze śniadaniem:
IAb = ½ (eAa + Inocleg ze śniadaniem)
Pauling obliczył eAb W przypadku kilku związków mierzył go eksperymentalnie i określił różnicę między dwiema wartościami, którą nazywał δ:
Δ = | (eAb) zmierzone - (eAb) Teoretyczne | = | (EAb) zmierzone - ½ (eAa + Inocleg ze śniadaniem) |
Pauling uzasadniał w ten sposób: jeśli δ jest bardzo blisko 0, oznacza to, że elektroonegaticzność obu pierwiastków jest podobna, a łącze, które je jednoczy, jest kowalencyjne. Ale jeśli δ nie jest mały, to związek między A i B nie jest czysty kowalencyjny.
Im większa wartość bezwzględna δ, tym większa różnica między elektroonegatywnością pierwiastków A i B, a zatem ogniwo, które Une będzie miało typ jonowy. Później czytelnik znajdzie przykład, w którym obliczanie δ można określić rodzaj łącza związku.
Równania dla elektroonywatywności
Począwszy od faktu, że różnica w energii jest sygnałem, który rozróżnia naturę ogniwa, Pauling przeprowadził wiele eksperymentów, które doprowadziły go do wyrażenia empirycznego wyrażenia względnej elektroungatyczności dwóch elementów do E B, które tworzą cząsteczkę.
Oznaczając taką elektrocjalność jak χ (litera grecka „chi”), Pauling zdefiniował δ w następujący sposób:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√δ
Może ci służyć: Tanteo Bilans: Kroki, przykłady i ćwiczeniaZauważ, że δ jest dodatnią ilością. Fatia f = 0.102, które wydaje się mnożące pierwiastek kwadratowy δ jest współczynnikiem konwersji między KJ (Kilojules) i EV (elektron-wolt), obie jednostki energii.
Jeśli zamiast tego stosowane są kilokalororie i wolt elektronów, różnica w elektroonegativities wyraża się z podobnym wzorem, ale z f = 0.208:
χ (a) - χ (b) = 0.208 ścian
Pauling zaczął przypisywać wodorowi wartość 2.1, poprzednia wartość uzyskana przez chemika Roberta Mullikena. Wybrał ten element jako punkt wyjścia, ponieważ tworzy kowalencyjne powiązania z wieloma innymi.
Poprzez poprzednie równanie kontynuował przypisywanie wartości związanych z resztą elementów. Uświadomił sobie, że elektroniagatyność wzrasta, gdy przesuwa się od lewej do prawej i od góry do dołu w stole okresowym, jak opisano w poprzednim rozdziale.
Przykład
Poniżej znajduje się lista elementów: N, J i M oraz ich odpowiednie elektroonegatywowości χ zgodnie ze skalą Paulinga:
-N: Χ = 4.0
-J: Χ = 1.5
-I: Χ = 0.9
-M: Χ = 1.6
Spośród następujących utworzonych związków:
YJ, YN, MN i JM
Wskaż ten z największym charakterem jonowym i tym, którego natura jest kowalencyjna. Powód twojej odpowiedzi.
Rozwiązanie
Zgodnie z kryteriami ustanowionymi przez Paulinga, związek o najwyższym charakterze jonowym będzie ten z największą różnicą między elektroonywentami, a zatem większą wartością δ. Ze swojej strony związek o najniższej różnicy energii jest ten, który ma kowalencyjne wiązanie.
Następnie obliczymy, ile δ jest warte dla każdego związku, jak następuje:
Związek YJ
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
Związek YN
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Związek Mn
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
Związek JM
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Z powyższych wyników wynika, że związek o charakterze jonowym jest YN, którego δ = 9.61, podczas gdy związek o charakterze kowalencyjnym jest JM, z δ = 0.01.

