Wyjaśnienie równowagi chemicznej, czynniki, typy, przykłady

- 4122
- 669
- Eliasz Dubiel
On Bilans chemiczny Jest to stan, który osiąga odwracalne reakcje chemiczne, w których nie powstaje żadne zmienność stężeń lub odczynników, ani zaangażowanych produktów. Charakteryzuje się dynamiką, a nie statyczną; to znaczy, cząsteczki lub atomy nadal reagują, ale utrzymują te same stężenia w czasie.
Podobna równowaga jest również przedstawiona w zmianach fazowych, chociaż nie ma przerw linków. Na przykład ciecz może być w równowadze z oparami, a także stałą. Podobnie stałe ustanawia równowagę z otaczającymi ją wódami, gdy wytrąci się lub krystalizują.
 W przemyśle chemicznym znajomość bilansu chemicznego jest niezbędna do uzyskania syntezy z lepszymi wydajnością. Źródło: Pxhere.
W przemyśle chemicznym znajomość bilansu chemicznego jest niezbędna do uzyskania syntezy z lepszymi wydajnością. Źródło: Pxhere. Po ustaleniu bilansu chemicznego nie jest możliwe uzyskanie większej liczby zmian lub reakcji, chyba że zostanie on przerwana lub wpływa na działania zewnętrzne. Jest to zatem w syntezie produktu, modyfikowane jest kilka parametrów, takich jak ciśnienie, objętość lub temperatura, tak że maksymalna ilość produktu jest generowana w równowadze.
W przeciwnym razie w równowadze ilości produktów będą niezadowalające; to znaczy będzie słaba wydajność reakcji. Właśnie dlatego równowaga chemiczna jest niezbędna dla przemysłu chemicznego i ogólnie dla każdej syntezy niezależnie od jego skali.
W równowadze chemicznej może być więcej produktów lub więcej odczynników. Wszystko zależy od tego, gdzie równowaga jest wypierana. Biorąc pod uwagę kilka czynników, możesz przenieść równowagę w kierunku dowolnego z dwóch kierunków podwójnej strzałki w odwracalnej reakcji.
[TOC]
Wyjaśnienie równowagi chemicznej
Przed równowagą
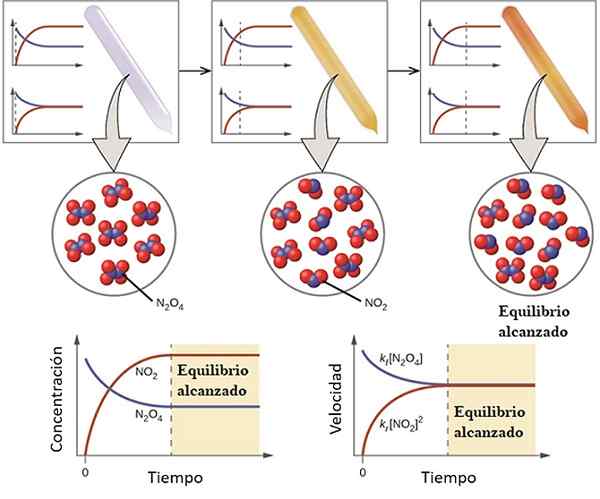 Przykład tego, jak reakcja zbliża się do jej równowagi. Źródło: OpenStex/CC przez (https: // creativeCommons.Org/licencje/według/4.0)
Przykład tego, jak reakcja zbliża się do jej równowagi. Źródło: OpenStex/CC przez (https: // creativeCommons.Org/licencje/według/4.0) Zrozumienie, jakie bilans chemiczny jest rozważony następującą odwracalną reakcję:
N2ALBO4(g) ⇌ nie2(G)
Gaz n2ALBO4 Jest bezbarwny, podczas gdy gaz nie2 przedstawia brązowe lub brązowe zabarwienie. Jeśli określona ilość N jest wstrzykiwana do małej fiolki lub pojemnika2ALBO4, Będzie to bezbarwne do momentu ustanowienia równowagi.
Po lewej stronie górnego obrazu widać, że prawie wszystkie cząsteczki są n2ALBO4 i że koncentracja NO2 Jest zero.
Pokaż także dwa wykresy, które reprezentują tendencję w równowadze, z kropkowaną linią wskazującą pozycję w momencie, gdy tylko N jest wstrzyknięty2ALBO4. Wykres odpowiada stężeniu vs. Czas (ręka w dół), a drugi odpowiada wykresowi z prędkością vs. Czas (prawy ręka).
Stężenie n2ALBO4, [N2ALBO4] (niebieska linia) będzie stopniowo zmniejszać się, ponieważ część jego dysocja2. Zatem będąc stężeniem NO2, [NIE2] (czerwona linia) na początku równa zero, wkrótce wzrośnie jako n2ALBO4 Dysocjować.
Jest to jednak odwracalna reakcja: część cząsteczek NO2 Dołączą do formularza n2ALBO4. Dlatego będą dwie reakcje, bezpośrednie i odwrotne, każda z własnymi prędkościami.
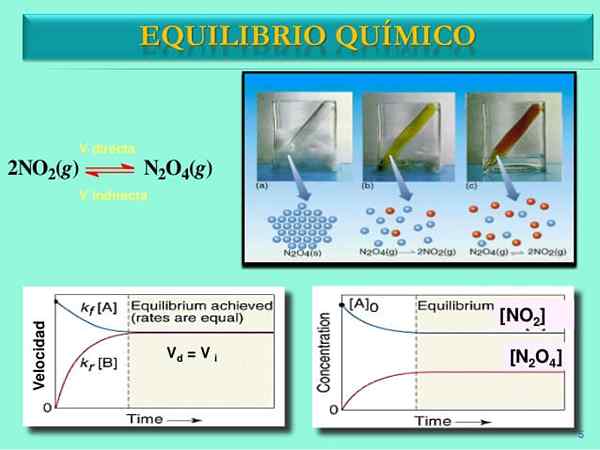 Źródło: Slideshare.internet
Źródło: Slideshare.internet Prędkości reakcji
Początkowo prędkość zużycia n2ALBO4 jest większa niż prędkość zużycia NO2. Oczywiście posiadanie tylko n2ALBO4, kilka cząsteczek utworzonych z NO2 Ledwo mogą zareagować. W tym momencie fiolka zacznie mrowić pomarańczowo, ponieważ istnieje mieszanka n2ALBO4 i nie2.
Stopniowo, ponieważ jest więcej cząsteczek NO2 Na drodze i że n cząsteczki2ALBO4 Odłączają się, prędkości dwóch reakcji będą pasowane, nawet jeśli stężenia różnią się od siebie. To znaczy nie2] zwykle jest większy niż [n2ALBO4], dlatego czerwona linia jest powyżej niebieskawej linii.
Może ci służyć: właściwości fizykochemiczneZauważ, że prędkość staje się DC/DT, to znaczy zmiana stężenia w odniesieniu do czasu. Dlatego dwa C vs. t i V vs. t nie są identyczne.
W równowadze
Kiedyś para n2ALBO4-NIE2 Ustaw równowagę, prędkości obu reakcji zostaną dopasowane i uzyskano następujące wyrażenia matematyczne:
Vbezpośredni = k1[N2ALBO4]
Vodwracać = k-1[NIE2]2
Vbezpośredni = Vodwracać
k1[N2ALBO4] = k-1[NIE2]2
k1/k-1 = [Nie2]2/ [N2ALBO4]
KEq = [Nie2]2/ [N2ALBO4]
W tym momencie droga zostanie farbowana jeszcze bardziej niż brąz, ponieważ równowaga jest bardziej wysiedlona w kierunku tworzenia [nie2]. To znaczy kEq, Stała równowagi musi być większa niż 1, biorąc pod uwagę wyższy związek, [nie2]2/ [N2ALBO4].
W stężeniach równowagi [n2ALBO4] i nie2] Pozostają stałe, przy czym obie reakcje występują z tą samą prędkością: pewna ilość n jest po prostu zdysocjowana2ALBO4, Ta sama ilość zostanie wytworzona natychmiast z powodu reakcji pewnej ilości NO2.
Z tego powodu mówi się, że równowaga chemiczna jest dynamiczna: cząsteczki n2ALBO4 i nie2 Nadal uczestniczą w reakcjach, nawet jeśli nie ma zmian w ich stężeniach.
I będąc równymi prędkościami reakcji dla obu zmysłów, czerwonej i niebieskawowej linii w grafice V vs. t graj na poziomej linii.
Stała równowagi
Stała równowagi dla poprzedniej reakcji zawsze będzie taka sama, w pewnej temperaturze, niezależnie od tego, ile n2ALBO4 jest wstrzyknięty na początku do drogi. Będzie tak nawet jeśli mieszanka n zostanie bezpośrednio wstrzykiwana2ALBO4 i nie2, Następnie w lewo w spoczynku, aż równowaga osiągnie.
Po osiągnięciu równowagi i mierzono stężenia [n2ALBO4] i nie2], związek [nie2]2/ [N2ALBO4] da to samo KEq Dla tej reakcji. Im większy jest (KEQ >> 1), tym więcej produktów będzie w równowadze. I mniejsze (Keq << 1), más reactivos habrá en el equilibrio.
Stężenia [n2ALBO4] i nie2] Nie zawsze będą. Na przykład, jeśli małe objętości zostaną wstrzykiwane do fiolki lub wręcz przeciwnie, są one wstrzyknięte potokom tych gazów do reaktora, ilości będą się znacznie różnić. Jednak kEq Pozostanie taki sam, o ile temperatura będzie taka sama w obu procesach.
KEq Jest podatny na zmiany temperatury: w wyższej temperaturze będzie większa wartość. To znaczy w wyższej temperaturze, w równowadze będzie to mieć tendencję do tworzenia większej liczby produktów. Jest tak, chyba że reakcja jest egzotermiczna, co zostanie wyjaśnione w następnym rozdziale.
Czynniki wpływające na równowagę chemiczną
Czynniki wpływające na równowagę chemiczną w odwracalnej reakcji to: stężenie, ciśnienie i temperatura.
- Stężenie
W reakcji odwracalnej, zgodnie z zasadą Le Chatliera, poprzez zwiększenie stężenia odczynnika nastąpi przemieszczenie bilansu chemicznego po prawej stronie, aby zwiększyć stężenie produktów reakcyjnych.
Przeciwnie, jeśli do reakcji zostanie dodany produkt, równowaga chemiczna przesunie się w lewo, w celu zwiększenia stężenia odczynników. Jeśli jako przykład traktuje następującą reakcję:
C (s) +o2(g) ⇌ 2 CO (g)
Zwiększając stężenie odczynników (C i O2), Równowaga przesunie się w prawo, to znaczy w kierunku tworzenia produktu tlenku węgla (CO) (CO). Ale wzrost stężenia CA spowoduje przemieszczenie równowagi w lewo, aby zwiększyć stężenie C i O2.
Może ci służyć: grupa karbonylowa: charakterystyka, właściwości, nomenklatura, reaktywność- Ciśnienie
W reakcji opracowanej w fazie gazowej zmienność objętości lub ciśnienia wywierana na zaangażowane w nią gaz, spowoduje zmianę bilansu, w zależności od liczby moli odczynników i produktów.
Jeśli składniki reakcji (odczynniki i produkty) mają różnice w liczbie moli biorących udział w reakcji, na przykład dimeryzacja dwutlenku azotu (NO2):
2 nie2(g) ⇌2ALBO4(G)
Wzrost ciśnienia wywierany na reakcję w fazie gazowej, konsekwencja spadku lub nie objętości reakcji, spowoduje przemieszczenie bilansu chemicznego z boku, która ma mniej moli gazowych. W tym przykładzie: produkt n2ALBO4.
Przeciwnie, spadek ciśnienia spowoduje przemieszczenie równowagi z boku reakcji, która ma największą liczbę moli gazu. W danym przykładzie przejdzie w kierunku odczynników (nie2), Aby przeciwdziałać spadku ciśnienia.
Jeśli w reakcji fazy sody mole odczynników są równe mole produktów, zmiany ciśnienia nie wpłyną na równowagę chemiczną.
- Temperatura
Reakcja endotermiczna
W reakcji endotermicznej ciepło można uznać za odczynnik, ponieważ jego podaż jest niezbędna do wystąpienia reakcji:
A +Q ⇌ B
Q = dostarczone ciepło
Dlatego w reakcji endotermicznej po wzroście temperatury równowaga przesunie się w prawo. Tymczasem, gdy temperatura maleje, równowaga przesuwa się w lewo.
Ciepło jest częścią odczynników, aby zużywać je w celu przekształcenia się w B.
Reakcja egzotermiczna
W reakcji egzotermicznej generuje się ciepło, jest to produkt reakcji:
A ⇌ B +Q
W reakcji egzotermicznej po wzroście temperatury równowaga przesunie się w lewo (odczynniki), ponieważ produkcja ciepła wzrasta. Tymczasem, gdy temperatura spadnie, równowaga przesunie się w prawo (produkty).
Ciepło jest częścią produktów, gdy wzrośnie temperatura, nie będzie potrzeby wnoszenia większego ciepła do środowiska. Dlatego równowaga będzie dążyć do wykorzystania dodatkowego ciepła, aby wytworzyć więcej odczynników; W tym przypadku więcej niż.
Rodzaje bilansu chemicznego
W zależności od stanu fizycznego składników reakcji równowaga chemiczna może być jednorodna lub heterogeniczna.
Jednorodna równowaga
W tego rodzaju równowagi, Wszystko Odczynniki i produkty mają ten sam status fazy lub cieczy. Na przykład:
N2(g) +3 h2(g) ⇌ 2 NH3(G)
Tutaj jest2, Jak h2 i NH3 Są to substancje gazowe.
Heterogeniczna równowaga
Istnieje, kiedy nie wszystko Odczynniki i produkty mają tę samą fazę lub stan fizyczny. Na przykład:
2 Nahco3(s) ⇌ na2WSPÓŁ3(s) +co2(g) +h2O (g)
Tutaj mamy Nahco3 i na2WSPÓŁ3 jako substancje stałe i co2 i H2Lub jako gazy lub opary.
Przykłady równowagi chemicznej
Dysocjacja kwasu octowego w wodzie
Kwas octowy, cho3COOH, dysocjuje w wodzie, ustalając równowagę:
Ch3COOH (AC) + H2Lub (l) ⇌ cho3Gruchać-(AC) + H3ALBO+(AC)
Reakcja, której stała równowagi nazywa się stałą kwasowości.
Izomeryzacjaalbon butanu
Gaz N-Butano można izomeryzować zgodnie z następującą odwracalną reakcją w celu wytworzenia izomeru izomerowego:
Ch3Ch2Ch2Ch3(g) ⇌ cho3CH (rozdz3)2(G)
Tworzenie tlenku azotu w atmosferze
W atmosferze można tworzyć tlenek azotu, choć bardzo ledwo, z azotu i tlenu powietrza:
N2(g) + lub2(g) ⇌ 2no (g)
Może ci służyć: co to jest środowisko? (Przykłady obliczeń)KEq Z tej reakcji wynosi 2,10-31 w 25 ° C, więc zostanie utworzona nikczemna ilość.
ReakcjaalboN srebra z AmonemSiemaAC
Srebrne jony, ag+, Można je ukończyć z amoniakiem zgodnie z następującą odwracalną reakcją:
Ag+(Słońce) + 2nh3(L) ⇌ [AG (NH3)2]+(słońce)
Rozwiązane ćwiczenia
Ćwiczenie 1
Jaki rodzaj równowagi chemicznej odpowiada następującej reakcji?
2nocl (g) ⇌ 2no (g) + cl2(G)
Ta reakcja odpowiada jednorodnej równowagi, ponieważ wszystkie zaangażowane substancje, NOCL, NO i CL2, Są gazy.
Ćwiczenie 2
W przypadku tej samej reakcji z góry można by się spodziewać zmiany równowagi, gdyby ciśnienie nagle wzrosło?
Policzmy mole odczynników:
2nocl
Mamy 2 mole NOCL. Teraz powiedzmy mole produktów:
2no + cl2
Mamy trzy mole: dwa z NO i jeden z Cl2. Na boku produktów jest więcej gazowych moli. Dlatego wzrost ciśnienia spowoduje przemieszczenie równowagi na lewą stronę w kierunku tworzenia NOCL. W ten sposób system stara się zmiękczyć skutki ciśnienia sprzyjające tworzeniu się NOCL, a nie NO i CL2.
Ćwiczenie 3
Dla tej samej reakcji z góry załóżmy, że nagle wstrzykiwana jest znaczna objętość CL2. Co się stanie, aby zrównoważyć?
Podczas dodawania CL2 do reaktora lub pojemnika jego stężenie rośnie jako produkt reakcji. I dlatego równowaga wróci z powrotem w lewo, aby utworzyć więcej NOCL.
Ćwiczenie 4
Jeśli dysocjacja NOCL w 227 ° C ma 4 stałą równowagi 4.5 · 10-4, W jakim kierunku jest wyparta równowaga?
Znowu bycie kEq mniej niż 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Ponieważ jest przesunięty w lewo.
Ćwiczenie 5
Zgodnie z następującą reakcją w równowadze:
[Co (och2)6]2+(AC) +4cl-(Ac) +q ⇌ [cocl4]2-(AC) +6H2Lub (l)
I wiedząc, że kompleks [co (och2)6]2+ Jest różowy i że kompleks jest [cocl4]2- Jest niebieskawo, jakie zmiany spodziewałbyś się sprawdzić, czy podgrzejesz pojemnik z [co (Oh2)6]2+? Czego byś się spodziewał, czy po podgrzaniu pojemnika umieściłbym go w łazience z lodem?
Reakcja jest endotermiczna, ponieważ pochłania ciepło, które jako odczynnik. Dlatego podczas podgrzewania pojemnika [co (OH2)6]2+, Równowaga przejdzie w prawo, w kierunku utworzenia [cocl4]2-. Niebieskawa różowa zmiana zabarwienia będzie.
Następnie, jeśli niebieskawe pojemnik na kolorowe [cocl4]2- Jest umieszczony w łazience z lodem, reakcja przesunie się teraz w lewo, w kierunku powstawania CO (OH2)6]2+:
[Cocl4]2-(AC) +6H2Lub (l) ⇌ [co (OH2)6]2+(AC) +4cl-(AC) +Q
Wynika to z faktu, że reakcja odwrotna jest egzotermiczna, mając ciepło, które jako produkt. Dlatego podczas chłodzenia pojemnika [cocl4]2- Niebieski, kompleks [co (och (och (och (och (Och (Och (2)6]2+, I pojawi się różowy kolor.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Prep. (S.F.). Rodzaje równowagi. Odzyskane z: EmedicPrep.com
- Bezgraniczna chemia Lumen. (S.F.). Czynniki, które sprzyjają równowagę chemiczną. Odzyskane z: kursów.Lumenarning.com
- Wikipedia. (2020). Bilans chemiczny. Źródło: w:.Wikipedia.org
- Chemia librettexts. (24 maja 2020). Obliczenia Equiquibrium - pod ilustracyjne badania. Odzyskane z: chem.Librettexts.org
- Meyers Amy. (2020). Równowaga: chemikalia i dynamiczna. Badanie. Odzyskane z: Study.com
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Bilans chemiczny w reakcjach chemicznych. Odzyskane z: Thoughtco.com
- « Kultury Gwatemali Charakterystyka, tradycje i zwyczaje
- Elektroforeza podkładowa, technika, do czego jest przykłady »

