Nomenklatura epoksydowa, uzyskiwanie, zastosowania, przykłady
- 3852
- 336
- Eugenia Czapla
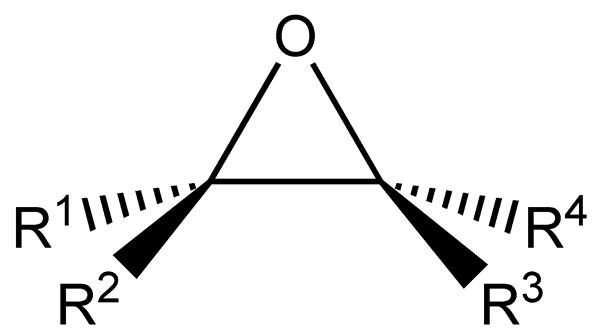
Epoksydy Są to alifatyczne lub cykliczne węglowodory, które mają atom tlenu połączony w tym samym czasie z dwoma atomami węgla w ich strukturze. Ten link, jak widać na niższym obrazie, przedstawia geometrię trójkątną, dość charakterystyczną dla wszystkich epoksydów.
Epoksydy pochodzą z alkenów, które cierpią na pęknięcie podwójnego wiązania z powodu utworzenia grupy funkcjonalnej epoksydowej. Każdy z dwóch atomów powiązanych z tlenem jest również powiązany z grupami bocznymi R1, R2, R3 i r4, wszystkie części tej samej cząsteczki.
 Strukturalny i ogólny wzór epoksydów. Źródło: Tomas Kindahl / Public Domena.
Strukturalny i ogólny wzór epoksydów. Źródło: Tomas Kindahl / Public Domena. Grupa funkcjonalna epoksydowa charakteryzuje się wielkim napięciem, co daje większą reaktywność niż eter niecykliczny. Reakcjom epoksydowym zwykle towarzyszy pęknięcie ich grupy funkcjonalnej.
Najprostszy epoksyd odpowiada epoksydowi etanu, zwanym także tlenkiem etylenu, tlenkiem etylenowym lub oksyrano. Z wszystkich jest to epoksyd o większym znaczeniu handlowym.
Największy odsetek produkcji epoksydu jest przeznaczony do malowania (powłoki powierzchniowe). Są one również stosowane w produkcji środków powierzchniowo czynnych, klejów, plastyfikatorów itp.
[TOC]
Nomenklatura
Związki z grupą funkcjonalną epoksydową można wywołać na różne sposoby, takie jak: epoksyd, epoksydy lub inne nazwy bez żadnej systematycznej konotacji, takie jak: oksirano.
Epoksydy o prostszych strukturach chemicznych są zwykle nazwane tlenkami. W ten sposób epoksyd propenu (c3H6) Nazywa się tlenkiem propenów (c3H6ALBO).
Często nazywane jest epoksydem węgle z identyfikacją epoksydu, które są obecne w grupie funkcjonalnej epoksydu. Na przykład: 2,3-epoksyheksan, 1,2-epoksychicloheksan i 1,2-epoksypropanu. To znaczy „trójkąt” znajduje się w węgle 2 i 3 heksanu, i tak dalej z cykloheksanem i propanem.
Może ci służyć: entalpiaUzyskanie
Katalityczne utlenianie
Epoksyd epoksydu etno lub etylenu jest wytwarzany przez katalityczne utlenianie etylenu w gorącym powietrzu lub tlenu, stosując jako metalowy srebrny katalizator:
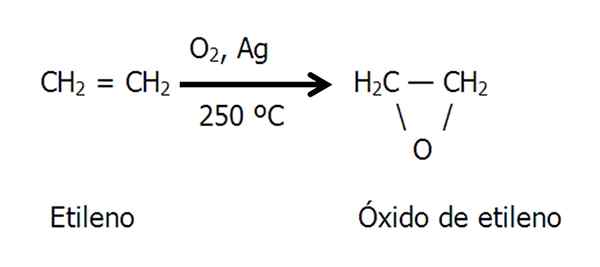 Równanie syntezy tlenku etylenu. Źródło: Gabriel Bolívar.
Równanie syntezy tlenku etylenu. Źródło: Gabriel Bolívar. Metoda chlorohydryny
Ta metoda wykonuje się w dwóch etapach: A) tworzenie chlorohydryny oraz B) leczenie chlorohydryny z podstawą do wyeliminowania kwasu solnego.
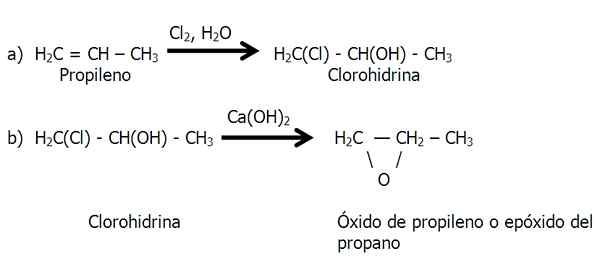 Etapy metody chlorohydryny do syntezy epoksydowej. Źródło: Gabriel Bolívar.
Etapy metody chlorohydryny do syntezy epoksydowej. Źródło: Gabriel Bolívar. Na etapie B) utracona cząsteczka HCl, której wodór pochodzi z grupy OH.
Peroksydacja podwójnego wiązania węglowego
Epoksydy mogą być również utworzone przez peroksydację alkenów, to znaczy utlenianie spowodowane przez bandyt, takiego jak kwas peroksybenzoesowy:
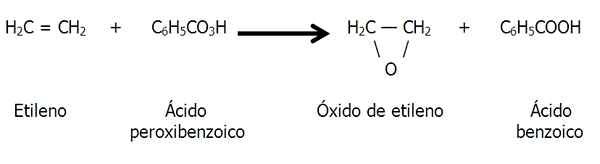 Peroksydacja etylenu z tworzeniem tlenku etylenu lub epoksydu etanu. Źródło: Gabriel Bolívar.
Peroksydacja etylenu z tworzeniem tlenku etylenu lub epoksydu etanu. Źródło: Gabriel Bolívar. Naturalna obecność epoksydów
Epoksydy mają nietypowy charakter. Jednak zaobserwowano syntezę epoksydów wątroby, za pośrednictwem cytochromu p450. Komórki wytwarzają epoksydy jako produkty utleniania alliquenos i związków aromatycznych.
Związki, takie jak epotylonas również w naturze, wytwarzane jako wtórny metabolit bakterii Sorangium celosum.
Aplikacje
Przygotowanie środków powierzchniowo czynnych
Tlenek etylenu jest często stosowany w przygotowaniu środków powierzchniowo czynnych lub środków powierzchniowo czynnych, produktów reakcyjnych alkoholu lub fenolu z tlenkiem etylenu. Środki powierzchniowo czynne wypełniają różne funkcje, w tym: nawilżacze, detergenty, emulgatory i rozpuszki.
Nawilżacze zwiększają nawodnienie powierzchni poprzez ułatwianie dostępu do wody. Detergenty eliminują brud z odzieży. Emulsje pozwalają i stabilizują emulsje. A leubilizatory umożliwiają rozpuszczenie kilku mieszanych związków z wodą.
Może ci służyć: Fick LawKleje i rozpuszczalniki
Reakcja epoksydów, w tym tlenku etylenu, z aminami jest podstawą przygotowania kolejek lub dziąseł pasty. Kleje te są wykorzystywane do wyprodukowania połączenia powierzchni, a także w stabilizacji PVC.
Tlenek etylenu reaguje z etokiem sodu w celu wytworzenia 2-toksietanolu, znanego również jako celosolve. Ten związek chemiczny rozpuszcza oleje, żywice, tłuszcze, woski, nitroceluloza i lacas.
Epoksydowa żywica
Żywice epoksydowe lub epoksydowe mają wśród swoich właściwości, po ich wzmocnieniu, wysoka odporność chemiczna, termiczna i mechaniczna. Te rezystancje pozwalają na ich zastosowanie do opracowania LACAS i emalii, a także do powlekania metali i podłóg laboratoryjnych oraz produkcji części elektrycznych.
Niektóre firmy używają tych żywic z wypełniaczami krzemionkowymi zastępującymi porcelanę do produkcji izolatorów linii elektrycznych. Żywice epoksydowe są również używane do wytwarzania arkuszy do drukowanych obwodów i płyt wzmocnionych szklanymi włókienami.
Żywice epoksydowe mają niewiele zastosowań osobno, w tym stabilność winylu. Aby zwiększyć ich przydatność, łączy się z kilkoma związkami w procesie znanym jako „utwardzone”. Wśród czynników użytych w tym celu mamy: pierwotne, wtórne, trzeciorzędowe i poliamidy.
Epoksydy uzyskane z olejków roślinnych są stosowane do syntezy polio, stosowane w przemyśle poliuretanowym.
Zastosowania medyczne
Epotylonas są produktami metabolicznymi bakterii Sorangium cellulosum, które mają właściwość stabilizujących mikrotubule, powodując w ten sposób blokowanie cyklu komórkowego.
Zastosowanie ixabepilonu, epotylonu, zostało zatwierdzone do leczenia zaawansowanego raka piersi. Podobnie, zastosowanie epotylonu D zostało zbadane w leczeniu choroby Alzheimera.
Może ci służyć: kwas disulfurowy: co to jest, struktura, właściwości, używaInne zastosowania
Tlenek etylenu interweniuje w syntezie glikolu etylenu: związek stosowany jako środek przeciw zamarzaniu w układach chłodzenia samochodów. Tlenek etylenu jest również stosowany w sterylizacji materiałów medycznych i instrumentów.
Toksyczność
Absorpcja poprzez skórę, inhalację lub spożycie epoksydowe są związane z wytwarzaniem toksycznych efektów, zarówno u ludzi, jak i zwierząt eksperymentalnych. Należą do nich: Podrażnienie tkanek powierzchniowych i uczulenie. Wytwarzane są również zmiany w funkcjonowaniu wątroby, komórkach krwi i szpiku kostnego.
Podobnie epoksydy z rakotwórczością i mutagennością były związane z epoksydami. Eporoksydy, ze względu na ich wysoką reaktywność elektrofiliczną i charakter wynajmowanych związków, zostały uznane za potencjalne czynniki rakotwórcze.
Przykłady epoksydów
Wreszcie zostaną wymienione niektóre inne przykłady epoksydów:
-1.2-epoksypropan
-2,3-epoksyheksan
-1.2-epoksykloheksan
-Rozciągliwy tlenek
-Tlenek izobutilenowy
-3.4-epoxi-1-butno
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Epoksyd. Źródło: w:.Wikipedia.org
- Leroy g. Przebrnąć. (2020). Epoksyd. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Manson m. M. (1980). Epoksydowie: czy jest to problem zdrowia ludzkiego? British Journal of Industrial Medicine, 37(4), 317-336. doi.Org/10.1136/OEM.37.4.317
- Chemikalia. (S.F.). Przykłady epoksydów. Odzyskane z: chemika.internet
- W.G. Garncarz. (1963). Chemia i zastosowania żywic epoksydowych, medycyna zawodowa, tom 13, wydanie 1, kwiecień 1963 r., Strony 42-47, doi.Org/10.1093/okresmed/13.1.42
- Molinero Muñoz, María i Fernández Arberas, Nerea. (2016). Epotylonas, alternatywa w dziedzinie przeciwnowotworowej. Complutense Madryt University.
- Alejandro Aguirre f. & Lesly Espinoza B. (2018). Zastosowania i zastosowania epoksji i siarczków. Central University of Ekwador. Odzyskane z: Akademia.Edu
- « Właściwości azotanów, struktura, nomenklatura, szkolenie
- Charakterystyka reakcji cannizzaro, mechanizmy, przykłady »

