Właściwości azotanów, struktura, nomenklatura, szkolenie
- 2723
- 199
- Estera Wojtkowiak
Azotany Są to wszystkie te związki, które nie zawierają anionu3-, Jeśli chodzi o sole nieorganiczne lub grupa nitro, -ono2, W przypadku instrumentów pochodnych organicznych. W nieorganicznych wszystkie azotany to sole metali lub jon amonowy, w których dominują interakcje elektrostatyczneN+NIE3-.
Na przykład azotan sodu3, Jest tworzony przez jony NA+ i nie3-. Ta sól, wraz z azotanem potasu, kno3, są najliczniejszymi okazami azotanów w naturze. Azotany znajdują się w glebie, w tkankach roślinnych, a przede wszystkim w złożach morza i soli fizjologicznej, takich jak Salitre, położone w Chile.
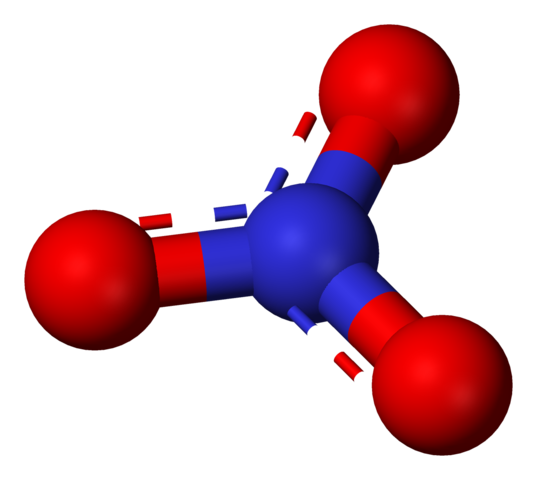
 Anion azotanowy reprezentowany przez modelki i pręty. Źródło: Benjah-BMM27 / Public Domena.
Anion azotanowy reprezentowany przez modelki i pręty. Źródło: Benjah-BMM27 / Public Domena. Termin „azotany” natychmiast nawiązuje do soli, nawozów i materiałów wybuchowych. Są również związane z mięsem i procesami utwardzania w celu hamowania wzrostu bakterii, a tym samym opóźniania ich pogorszenia. Azotany są również synonimami warzyw, ponieważ zawierają duże ilości tych soli.
On nie3- (Obraz najwyższy) jest najbardziej utlenioną postacią azotu, który jest końcowym i asymilacyjnym produktem jego cyklu biologicznego. Azot atmosfery cierpi kilka transformacji, zarówno w drodze promieni elektrycznych, albo poprzez działania drobnoustrojów, aby stać się NH4+ i nie3-, zarówno rozpuszczalne w wodzie, jak i wchłanialne przez rośliny.
Azotany są stosowane jako środki utleniające, nawozy, materiały wybuchowe i leki kardiologiczne. To ostatnie użycie bardzo kontrastuje z innymi, ponieważ metabolizują lub wchodzą w interakcje z ciałem w taki sposób, aby rozszerzają żyły i tętnice; I dlatego następuje wzrost i poprawa przepływu krwi, łagodząc ból serca.
[TOC]
Właściwości azotanów
Neutralność
Azotany są w zasadzie substancje neutralne, jak nie3- Jest to skoniugowana podstawa kwasu azotowego, HNO3, Silny kwas. W wodzie nie jest to zależne:
NIE3- + H2Lub ⇌ hno3 + Oh-
W rzeczywistości można powiedzieć, że ta hydroliza w ogóle nie występuje, ilości OH jest nikczemne-. Dlatego roztwory wodne azotanu są neutralne, chyba że występują inne rozpuszczone substancje.
Wygląd zewnętrzny
Azotany nieorganiczne składają się z soli, których ogólne wzory są m (nie3)N, istnienie N Jest to walencja lub dodatnie obciążenie metalicznego kationu. Wszystkie te azotany mają krystaliczną jasność i mają białawe kolory. Jednak azotany metali przejściowych mogą być kolorowe.
Na przykład azotan miedzi (II) lub azotan kupowy, Cu (no3)2, Jest to niebieskawo krystaliczne stałe. Tymczasem azotan niklu (ii), ani (nie3)2, To solidny szmaragdowy kolor. Niektóre inne azotany, takie jak żelazo, prezentują słabe kolory.
Z drugiej strony, azotany organiczne są zwykle bardzo wrażliwe i wybuchowe stałe lub stałe.
Może ci służyć: żywa materia: koncepcja, cechy i przykładyRozkład termiczny
Azotany metalu są wrażliwe na wysokie temperatury, ponieważ zaczynają się rozkładać zgodnie z następującym równaniem chemicznym:
2m (nie3)2(s) → 2MO (s)+4no2(g)+lub2(G)
Jak zaobserwowano, azotan metalu rozkłada się w tlenku, MO oraz dwutlenek azotu i tlenu. Ten rozkład termiczny nie występuje w tej samej temperaturze dla wszystkich azotanów; Niektórzy opierają się bardziej niż inni.
Zasadniczo większy i mniejszy ładunek kationu m+, większa będzie temperatura, w której azotan musi zostać podgrzewany, aby się rozbić. Zamiast tego, kiedy m+ Jest mały lub ma duże obciążenie dodatnie, azotan rozkłada się w niższych temperaturach, a zatem bardziej niestabilny.
Na przykład azotan sodu3, Rozkłada się w temperaturze niższej niż w azotanie baru, BA (nie3)2, Cóż, chociaż BA2+ mają większe obciążenie niż na+, Jego rozmiar jest znacznie większy.
Środek utleniający
On nie3- Jest to stosunkowo stabilny anion. Jednak jego atom azotowy jest silnie utleniony, ze stanem utleniania +5 (n5+ALBO32-), Więc jest to „spragnione” elektronów. Z tego powodu azotan jest środkiem utleniającym, który będzie starał się chwytać substancje wokół niego elektrony.
Jest to brak elektronów w atomie azotu NO3- Co robi nano3 I Kno3 silne środki utleniające, stosowane jako komponenty prochu. Dodając do tej cechy fakt, że gazy są uwalniane2 I2 Podczas rozkładu rozumie się, dlaczego jest częścią wielu materiałów wybuchowych.
Gdy azotan zyskuje elektrony lub zmniejsza się, można go przekształcić w amoniak, NH3, lub w tlenku azotu, nie, w zależności od odczynników i warunków.
Rozpuszczalność
Wszystkie azotany nieorganiczne lub to samo, azotany metalu i amonu, NH4NIE3, Są to związki rozpuszczalne w wodzie. Wynika to z faktu, że cząsteczki wody mają silne powinowactwo3-, I że krystaliczne sieci tych azotanów nie są bardzo stabilne.
Struktura
Anion azotanowy
 Struktury rezonansu azotanu. Źródło: Benjah-BMM27 / Public Domena.
Struktury rezonansu azotanu. Źródło: Benjah-BMM27 / Public Domena. Górny obraz pokazuje struktury rezonansowe anionu azotanu. Jak widać, dwa ładunki ujemne znajdują się w dwóch atomach tlenu, które są demokalizowane między trzema atomami tlenu. Dlatego każdy lub ma obciążenie -2/3, podczas gdy azot ma obciążenie +1.
Więc nie3- Interakcja elektrostatycznie lub tworzą łącza koordynacyjne poprzez dowolny z trzech atomów tlenu.
Solidki
Wszystkie azotany nieorganiczne są soli fizjologicznych i jonowych. Dlatego jego struktury są krystaliczne, co oznacza, że jego jony, m+ i nie3-, Są ułożone w przestrzeni dzięki interakcjom elektrostatycznym. W zależności od tych interakcji ich kryształy przedstawią różne struktury.
Może ci służyć: po co jest romb bezpieczeństwa i do czego służy?Na przykład krystaliczna struktura Nano3 Jest to trygonalne lub romboedica, podczas gdy kno3 Jest ortorombowy.
Azotany organiczne
Azotany organiczne są reprezentowane z ogólną wzorem Rono2, gdzie r jest grupą alkilową lub aromatyczną. Związki te charakteryzują się ich linkiem R-Aon2, i zwykle składają się z pochodnych azotowych polimerów i innych substancji organicznych.
Złożony
On nie3- Koordynuje z centrami metalowymi, tworząc link m+-ALBO NIE2-, Bycie inną interakcją niż jonowe. Te kompleksy są zasadniczo nieorganiczną. Azotan można nawet koordynować przy użyciu dwóch jego atomów tlenu jednocześnie, m+-ALBO2NIE.
Nomenklatura
Aby wyznaczyć azotan, słowa „azotan”, a następnie nazwa kationu lub grupy, która towarzyszy mu w ich odpowiednim wzorze chemicznym, muszą zostać napisane najpierw. Walencja kationu jest określona w nawiasach, gdy posiada więcej niż jeden. Podobnie sufiks można używać -Co i -Oy, jeśli tak preferowane, po tradycyjnej nomenklaturze.
Na przykład rozważ wiarę (nie3)3. Nazwa nazywana jest azotan żelaza (III), ponieważ jego wartościowość wynosi +3, lub może być również nazywana azotanem żelaza.
Zasady te dotyczą również azotanów organicznych, pod warunkiem, że ich struktury są proste. Na przykład Cho3ALBO NIE2 Nazywa się azotanem metylu, ponieważ grupa -ch3 Staje się grupą R, która towarzyszy -ONO2.
Szkolenie
Naturalny
Azotany powstają w naturze jako część biologicznego cyklu azotu. Z tego powodu gleby, morza i niektóre prądy wodne mają znaczne ilości azotanów. W zależności od otaczających jonów powstają różne sole azotanów, będąc nano3 I Kno3 Najczęstsze i obfite.
Przemysłowy
Azotany powstają w skali przemysłowej przez neutralizację kwasu azotowego, albo z wodorotlenkami metali, alkoholi, polimerów itp. Na przykład azotan wapnia, CA (nie3)2, Można go przygotować zgodnie z następującym równaniem chemicznym:
CA (OH)2 + 2hno3 → Ca (nie3)2 + 2h2ALBO
Podobnie kilka substancji organicznych jest atakowanych przez HNO3 w pewnych warunkach promocja zastąpienia niektórych ich grup przez -ono2. Tak dzieje się z reakcją celulozy, aby przekształcić się w nitrocelulozę lub azotan celulozowy, materiał polimerowy i wybuchowy.
Fotokatalityczne
Anion nr3-, A zatem azotany nieorganiczne mogą być utworzone przez fotokatalityczne działanie odpadów tlenku tytanu, wujka2, Używanie jako surowca nic więcej niż azot i tlen powietrza. To badanie zakłada, że tam, gdzie są ekscesy faceta2, Będą niechciane ilości3-, które wpływają na zdolność do wody i mogą obejmować glony.
Może ci służyć: aldehydoAplikacje
Utwardzanie mięsa
 Kiełbasy to jedno z przetworzonych mięs, które zawierają więcej azotanów. Źródło: Pxhere.
Kiełbasy to jedno z przetworzonych mięs, które zawierają więcej azotanów. Źródło: Pxhere. Azotany są dodawane do kilku mięs, zwłaszcza kiełbas, aby wyeliminować bakterie, a tym samym opóźnić ich pogorszenie. Reagują również ze swoimi białkami, aby nadać im bardziej czerwony kolor. Problem tych mięsa polega na tym, że gotując je w wysokich temperaturach, wytwarzają nitrozoaminy: związki związane z rakiem okrężnicy.
Ta reakcja jest częściowo unikana, jeśli występują witaminy, podobnie jak w przypadku warzyw, które, chociaż są bogate w azotany, nie są związane z patologiami rakotwórczymi.
Rolnictwo
Azotany są rozpuszczalnym źródłem azotu. Dlatego służy jako nawóz, aby przyczynić się do azotu do roślin, a tym samym sprzyja ich wzrostowi.
Medycyna
Azotany mają specjalną funkcję w organizmie. Podczas asymilacji przez działanie enzymatyczne jest ono redukowane do tlenku azotu, nie. Ta cząsteczka zajmuje objętość i rozszerza żyły i tętnice, pozwalając na większy przepływ krwi. Dlatego azotany są stosowane jako leki do zwalczania patologii układu krążenia.
Ironiczne i, co ciekawe, w tym celu zastosowano azotany organiczne, takie jak glicerylo, nitrogliceryna, izosorbid mononitran i tetranitran pentaeritrytolowy.
Materiały wybuchowe
Azotany są używane w preparatach wybuchowych, a prochowa jest najbardziej symbolicznym przykładem. Będąc utlenieniem środków, faworyzują spalanie materii, oprócz przyczyniania się do nagłego rozszerzenia objętości z powodu uwalniania gazów po rozkładu.
Przykłady azotanów
W poprzednich sekcjach wspomniano więcej niż jeden przykład azotanów. Wreszcie, niektóre inne zostaną wymienione wraz z odpowiednimi formułami i nazwami:
-Bielizna3: Azotan litu
-RBNO3: Azotan Rubidio
-Mg (nie3)2: Azotan magnezu
-SC (nie3)2: Azotan Scandio
-CR (nie3)3: Azotan chromowy (iii)
-Zn (nie3)2: azotan cynku
-PB (nie3)2: azotan ołowiowy (ii)
-Agno3: azotan srebra
-Ch3Ch2ALBO NIE2: Azotan etylu
-Ch3(Ch2)4ALBO NIE2: Azotan amilo
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Clark J. (5 czerwca 2019). Stabilność termiczna azotanów i węglanów. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wikipedia. (2020). Azotan. Źródło: w:.Wikipedia.org
- Angela Dowden. (12 marca 2019 r.). Prawda o azotanach w twojej żywności. Źródło: BBC.com
- Elsevier b.V. (2020). Azotan. Scientedirect. Pobrano z: Scientedirect.com
- Dr. Biji s. I prof. Govindan v. (26 kwietnia 2017 r.). Rola azotanów organicznych w optymalnym leczeniu dławicy piersiowej. Europejskie Towarzystwo Kardiologii. Odzyskane z: Escardio.org
- Yuan, s., Chen, J., Lin, z. i in. (2013). Tworzenie azotanów z azotu atmosferycznego i tlenu fotokatalizowane przez nanoprzewodowe dwutlenek tytanu. Nat Commun 4, 2249. doi.Org/10.1038/NCOMMS3249
- « Terapia narracyjna podstawy Michaela White'a, procedura, techniki
- Nomenklatura epoksydowa, uzyskiwanie, zastosowania, przykłady »

