Wiązanie chemiczne
- 4496
- 256
- Maksymilian Kępa
Wyjaśniamy, jakie są linki chemiczne, takie typy, i podajemy wiele przykładów
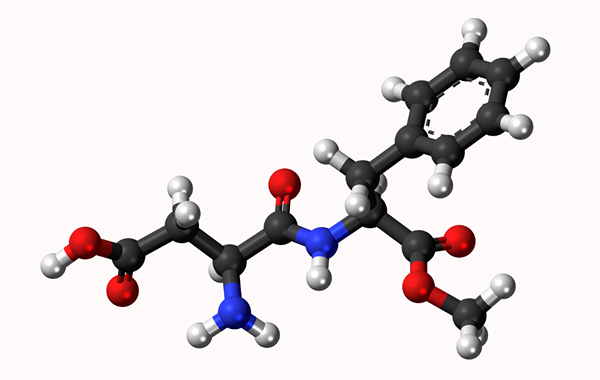
 Model molekularny aspartamo: prosty link reprezentowany przez linię i podwójne wiązanie przez dwie linie. Kulki to atomy
Model molekularny aspartamo: prosty link reprezentowany przez linię i podwójne wiązanie przez dwie linie. Kulki to atomy Co to jest wiązanie chemiczne?
A Wiązanie chemiczne Jest to siła, która utrzymuje się wraz z atomami związku. Siła, która jednoczy atomy, jest elektromagnetyczna, a gdy atomy są związane, zachowują własną naturę.
Na przykład powstaje wspólna woda z powodu połączenia dwóch atomów wodoru (h (h2) i jeden z tlenu (O); Dlatego jego formuła chemiczna jest h2ALBO. Chociaż są zjednoczeni z tworzeniem wody, atomy wodoru pozostają wodoru, a tlen nadal jest tlenem.
Przypomnij sobie, że atomy są tworzone przez jądro otoczone chmurą elektronów, które mają obciążenie ujemne. Jądro atomu ma ładunek dodatni, który udaje się przyciągnąć elektrony.
Jednak elektrony są również przyciągane do jąder innych atomów. W ten sposób powstają linki chemiczne. Fakt, że atomy dają lub udostępniają elektrony generują różne rodzaje połączeń chemicznych.
W wiązaniach chemicznych atomy dają, wygrywają lub dzielą elektrony tak zwanej warstwy Walencji, która jest najbardziej zewnętrzną warstwą atomu, w którym występuje reaktywność lub tendencja do tworzenia wiązań chemicznych.
Linki te wytwarzają nowe substancje (nie mieszanki), których nie można oddzielić za pomocą technik takich jak sito lub filtrowanie.
Rodzaje wiązań chemicznych
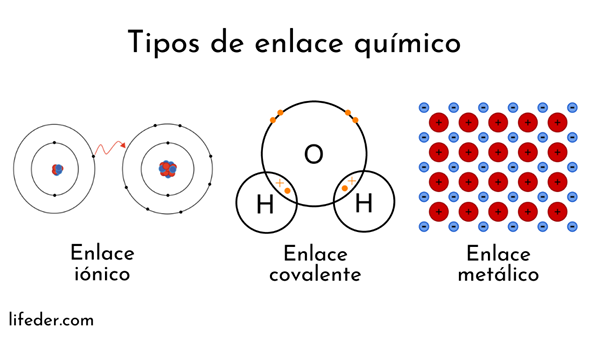
Atomy są tworzone przez jądro (z dodatnim ładunkiem elektrycznym) i elektrony (cząstki z ujemnym ładunkiem elektrycznym), które obracają się wokół. Obie strony interweniują w wiązania chemiczne.
Wiązania chemiczne obejmujące jądra atomowe nazywane są metalową. Z drugiej strony osoby obejmujące wymianę elektronów są podzielone na jon i kowalencyjne.
Może ci służyć: chlorobenzen (C6H5CL)Linki jonowe
Ten typ łącza jest bardzo odporny; wytwarza stałe związki chemiczne (kryształy) w wodzie i o wysokiej temperaturze topnienia (między 300 a 1.000 stopni Celsjusza). Rozpuszczone w wodzie są to przewody energii elektrycznej.
Jak tam linki jonowe?

Wiązania jonowe występują między metalem a nie -metalowym, które mają inną elektrooniczność (zdolność do przyciągania elektronów). Elektrony warstwy Walencji jednego atomu przechodzące do drugiego atomu Walencji. Który jest taki sam; Metaliczny atom daje elektron nietopelem atomem, osiągając stabilność elektroniczną.
W całym procesie tworzenia linków powstają jony (kationy i aniony), stąd nazwa wiązania jonowego.
Przykładem tego rodzaju wiązania jest chlorek sodu: ten związek chemiczny powstaje, gdy chlor (CL) przyciąga elektron warstwy walencyjnej o atomie sodu (Na).
Innym przykładem jest chlorek manganu (MGC), który jest stosowany w produkcji obrazów i środków dezynfekujących. W wyniku wiązania chemicznego elektrony atomu manganu są wchłaniane przez atom chloru.
Kowalencyjne linki
Kowalencyjne wiązania są bardzo twarde i generują nierozpuszczalne związki chemiczne o wysokiej temperaturze fuzji (ponad 1.000 stopni Celsjusza). Nie prowadzą energii elektrycznej.
Zgodnie ze sposobem, w jaki atomy dzielą swoje elektrony, mogą być wiązania kowalencyjne:
- Prosty: Dzielą kilka elektronów (A-A).
- Podwójnie: Udostępnij dwie pary elektronów (a =).
- Potroić: Udostępnij trzy pary elektronów (A≡A).
Jak powstają kowalencyjne obligacje?

Wiązanie kowalencyjne powstaje, gdy dwa elementy niemetaliczne dzielą elektrony ich warstwy walencyjnej.
Może ci służyć: Rubidio: History, właściwości, struktura, pozyskiwanie, użyciaWymiana elektronów zawsze występuje w taki sposób, że jest zgodny z prawem oktetów. Jest to zasada chemiczna, która stwierdza, że najbardziej stabilna konfiguracja atomu jest taka, w której ma osiem elektronów w swojej najbardziej zewnętrznej warstwie.
Przykładem wiązania kowalencyjnego jest woda (h2ALBO). Aby stworzyć cząsteczkę wody, potrzebne są dwa proste wiązania kowalencyjne. W prostym wiązaniu elektron wodoru jest dzielony z tlenem, a tlen ma elektron z wodorem.
Innym przykładem wiązania kowalencyjnego jest dwutlenek węgla (CO2), jeden z głównych odpowiedzialnych za efekt cieplarniany i zmiany klimatu. Aby utworzyć ten związek, węgiel i tlen tworzą dwa podwójne wiązania, to znaczy dla każdego łącza dwie pary elektronów dzielą.
Metalowe linki
Ten typ łącza dzieje się tylko w metalowych elementach. Składa się ze zjednoczenia jąder dwóch atomów tego samego elementu metalicznego wraz z ich elektronami.
Połączenia metalowe charakteryzują się jako skuteczne przewody energii elektrycznej, posiadanie bardzo wysokiej temperatury fuzji i wrzenia oraz łatwe utlenianie. Są również plastyczne i odporne na zarysowania, bardzo solidne i mocne.
Jak tam metalowe linki?
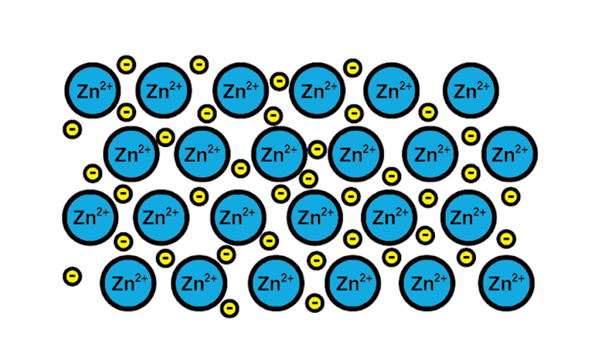 Link metaliczny cynku
Link metaliczny cynku Przykładem metalicznego łącza jest cynk, element metaliczny. Proces szkoleniowy tego typu linku to:
1-A jądro atomowe elementu metalicznego spotyka kolejne jądro tego samego elementu.
2-Elektrony warstwy Walencji obu jąder stają się morzem elektronów. To znaczy nie orbitują jednego jądra atomowego.
3-Przyciągane są dodatnie obciążenia jąder atomowych i negatywy elektronów. Rezultatem są elektrony walencyjne, które tworzą morze elektronów wokół jąder atomowych (kationów).
Może ci służyć: siarczan miedzi (CUSO4): struktura, właściwości, uzyskiwanie, użyciaPrzykłady wiązania chemicznego
Linki jonowe
- Tlenek baru (BAO).
- Chlorek magnezu (MGCL2).
- Tlenek wapnia (CAO)
- Azotan srebra (Agno3)
- Wodorotlenek cynku (znoh2)
- Bromid potasowy (KBR)
- Węglan wapnia (caco3)
- Siarczan miedzi (cuo4)
- Fluor litowy (LIF)
- Chlorek manganu (MNCL2)
- Siarczan potasu (k2południowy zachód4)
- Tlenek żelaza (brzydki)
- Fosforan disod2HPO4)
- Potasu joduro (ki)
Kowalencyjne linki
- Dwutlenek węgla (co2)
- Amoniak (NH3)
- Parafin (CNH2N+2)
- Diesel (c12H26)
- Dibromo (br2)
- Tlenek węgla (CO)
- Butano (c4H10)
- Benzen (c6H6)
- Azot molekularny (n2)
- Metan (rozdz4)
- Kwas chlorowy (HCL)
- Kwas cyjanhydowy (HCN)
Metalowe linki
Każdy metal w swoim czystym stanie jest przykładem metalowego ogniwa, a mianowicie:
- Nickel (NI)
- Żelazo (wiara)
- Aluminium (AL)
- Tytan (ti)
- Ołów (PB)
- Kobalt (co)
- Miedź (cu)
- Cynk (Zn)
- Merkury (HG)
- Złoto (au)
- Srebro (ag)
- Bar (BA)
Znaczenie wiązań chemicznych
Znaczenie wiązań chemicznych polega na tym, że tworzą one cząsteczki organiczne i nieorganiczne, w ten sposób są częścią podstawy wszystkich żywych organizmów. Jeśli są poddane określonym warunkom, łącza te można złamać. Ta energia nazywa się Połącz energię.
Niektóre techniki przełamania linków są stosowane przez energię elektryczną, wysokie temperatury lub wywołujące reakcje chemiczne z różnymi związkami.
Na przykład, aby oddzielić cząsteczki tlenu i wodoru od H2Lub możemy zastosować energię elektryczną do wody, która jest procesem znanym jako elektroliza.
Związki chemiczne utworzone przez link są liczne i są obecne w życiu codziennym. Sól, której używamy do przyprawowania żywności, jest chemicznym produktem związku między atomem sodu (NA) a jednym atomem chloru (CL) (CL). Jego wzorem chemicznym jest NaCl, który odczytuje chlorek sodu.

