Jaki jest najbardziej elektroonywalny element i dlaczego?
- 3582
- 195
- Gabriela Łuczak
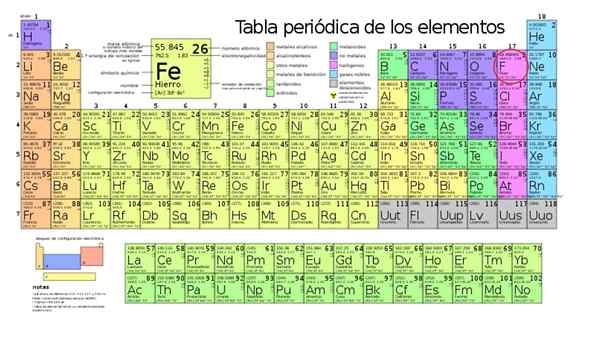
 Najbardziej elektroonegatywnym elementem jest fluor (F), zablokowany w czerwonym okręgu
Najbardziej elektroonegatywnym elementem jest fluor (F), zablokowany w czerwonym okręgu On Więcej elementu elektroongeneracyjnego W stole okresowym jest to fluor, którego chemikalia jest F i należy do grupy halogenowej. Spośród wszystkich elementów stolika okresowego fluor jest najbardziej pragnąca uchwycić elektrony z innych atomów.
Ten element, gazowy w temperaturze pokojowej, jest wysoce reaktywny i dlatego nie jest łatwo znaleźć go w czystym stanie w naturze. Fluor łatwo łączy się z innymi pierwiastkami, takimi jak siarka, wapń i metale, a także liczne związki, zwłaszcza te zawierające wodór.
Jego wysoka elektrooniczność pozwala nawet łączyć się z gazami szlachetnymi, takimi jak Xenon, Kripton i Radon.
Po fluorze tlen jest drugim pierwiastkiem o najwyższej elektroonegatywności. W przeciwieństwie do tego, elementy o najniższej elektroungatyczności są Francio (FR) i Cesium (CS).
 Ponieważ jest to najbardziej elektroonegatywny element, fluor tworzy liczne związki, takie jak fluoryt lub fluor wapnia. Źródło: Wikimedia Commons
Ponieważ jest to najbardziej elektroonegatywny element, fluor tworzy liczne związki, takie jak fluoryt lub fluor wapnia. Źródło: Wikimedia Commons Są to zatem najbardziej elektrododatni które istnieją, chociaż Francio ma radioaktywny i bardzo mało obfity charakter.
Elektroniarzowość i stół okresowy
Skala elektroungatywności została opracowana przez chemika i nagrodę Nobel Linus Pauling (1901–1994), chociaż koncepcja jest spowodowana szwedzkim chemikiem Jöns Jakob Berzelius (1779–1848).
Skala Paulinga, która przypisuje wymiary wartości numeryczne do elektroonegatywności, jest używana do pomiaru intensywności, z jaką atom przyciąga elektron innego atomu, a zatem tworzy połączenia.
Każdy element ma swoją własną elektrooniczność, która zależy od jego właściwości atomowych. Jest to określone eksperymentalnie i pośrednio, na przykład, mierząc energię łącza, podobnie jak Pauling około 1932 r.
W skali elektroungatityzacji Paulinga fluor jest pierwszy, z przybliżoną wartością 3.98 ≈ 4.0.
Może ci służyć: węglowodory alifatyczne: właściwości, nomenklatura, reakcje, typyElektroniarzowość jest okresową właściwością pierwiastków. W większości przypadków (istnieją pewne wyjątki), zaobserwowano, że elektroniagatywność wzrasta podczas przechodzenia od lewej do prawej przez szeregi stolika okresowego.
A także zwiększ się od dołu do góry, poruszając się na kolumnie.
 Okresowa tabela elektroungatoryczności zgodnie ze skalą Paulinga. Fluor jest najbardziej elektrowni, znajdującym się powyżej i po prawej, podczas gdy Francio jest najmniej elektroungatywną ze wszystkich lub najbardziej elektropozytywnym, jeśli jest preferowany, i jest w kolumnie lewej i w dół. Źródło: f. Zapata.
Okresowa tabela elektroungatoryczności zgodnie ze skalą Paulinga. Fluor jest najbardziej elektrowni, znajdującym się powyżej i po prawej, podczas gdy Francio jest najmniej elektroungatywną ze wszystkich lub najbardziej elektropozytywnym, jeśli jest preferowany, i jest w kolumnie lewej i w dół. Źródło: f. Zapata. Elektroezeria fluorowa
Powodem, dla którego fluor jest najbardziej elektroonegatywnym elementem w tabeli okresowej, jest jego konfiguracja elektroniczna (sposób, w jaki jej elektrony są ułożone w orbitale wokół jądra).
Ta konfiguracja wynosi 1s22s22 p5, Więc fluor ma 5 elektronów w swojej najbardziej zewnętrznej warstwie.
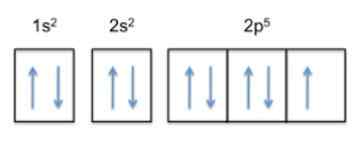
Teraz, ponieważ trendem atomu jest uzupełnienie swojej zewnętrznej warstwy, oznacza to, że fluor z łatwością zaakceptuje elektron innych atomów, aby uzyskać stabilność i przypominać szlachetny gaz tego samego rzędu, który jest neonem , którego konfiguracja elektroniczna wynosi 1s22s22 p6.
Atom fluorowy ma bardzo mały promień, ponieważ protony w jądrze bardzo mocno przyciągają elektrony, utrzymując je bliżej niż w atomach mniejszych pierwiastków elektroonegatywnych, takich jak cesium i Francio.
Dlatego te ostatnie są gotowe łatwo zrezygnować z elektronów, aby utworzyć linki.
Bibliografia
- Aguilar, c. Przewodnik po jednostce uczenia się chemicznej I. Źródło: IPN.MX.
- Atkins, str. (2005). Zasady chemii, ścieżki odkrywania. 3. Wydanie. Pan -american Medical Redaktorial.
- Clark, J. Elektonegiczność. Odzyskane z: chem.Librettexts.org.
- Hein, m. (2014). Fundamenty chemii college'u. 14. edycja. Wiley.
- Lentech. Elementy chemiczne uporządkowane przez jego elektrooniczność. Odzyskane z: lentech.Jest.

