Gibbs Free Energy jednostki, sposób obliczania, rozwiązane ćwiczenia

- 988
- 261
- Marianna Czarnecki
Bezpłatna energia Gibbs (powszechnie nazywane g) jest potencjałem termodynamicznym zdefiniowanym jako różnica w entalpii H, z wyjątkiem iloczynu temperatury t, przez entropię systemu:
G = h - t s
Gibbs Free Energy jest mierzona w dżuli (według systemu międzynarodowego) w ERGIOS (dla systemu ligowego jednostek), w kalorii lub woltach elektronów (Dla elektro woltów).
 Rysunek 1. Schemat pokazujący definicję energii Gibbs i jej związek z innymi potencjałami termodynamicznymi. Źródło: energia jądra.internet.
Rysunek 1. Schemat pokazujący definicję energii Gibbs i jej związek z innymi potencjałami termodynamicznymi. Źródło: energia jądra.internet. W procesach występujących przy stałym ciśnieniu i temperaturze zmienność energii swobodnej Gibbs wynosi δG = δH - t δs. W takich procesach (g) reprezentuje energię dostępną w systemie, która może stać się pracą.
Na przykład w egzotermicznych reakcjach chemicznych entalpia zmniejsza się, podczas gdy entropia rośnie. W funkcji GIBBS te dwa czynniki są przeciwdziałane, ale tylko wtedy, gdy energia Gibbsa zmniejsza reakcję.
Jeśli więc zmienność G jest ujemna, proces jest spontaniczny. Gdy funkcja GIBBS osiągnie minimum, układ osiąga stabilną równowagę. Krótko mówiąc, w procesie, dla którego ciśnienie i temperatura pozostają stałe, możemy potwierdzić:
- Jeśli proces jest spontaniczny, to ΔG < 0
- Gdy system jest w równowadze: ΔG = 0
- W procesie niestabilnym wzrasta: ΔG> 0.
[TOC]
Jak to jest obliczane?
Gibbs Free Energy (G) jest obliczany na podstawie definicji podanej na początku:
G = H - THSS
Z kolei entalpia H jest potencjałem termodynamicznym zdefiniowanym jako:
H = u + p v
- Krok po kroku
Następnie zostanie przeprowadzona analiza kroku -step, aby poznać niezależne zmienne, które energię Gibbs jest funkcją:
1- Z pierwszego prawa termodynamiki energia wewnętrzna jest związana z entropią systemu i jego objętością V dla odwracalnych procesów poprzez relację zróżnicowaną:
Może ci służyć: etydium bromek: struktura, właściwości, zastosowania, toksycznośćdu = dq - dw = tds - PDV
Z tego równania wynika, że energia wewnętrzna u jest funkcją zmiennych S i V:
U = u (s, v)
2- Począwszy od definicji H i przyjmuje różnicę:
DH = du + d (p v) = du + vdp + pdv
3- Zastąpienie wyrażenia DU uzyskanego w (1) musisz:
DH = TDS - PDV + VDP + PDV = TDS + VDP
Stąd stąd stwierdza się, że entalpia H zależy od entropii i ciśnienia P, to znaczy:
H = H (S, P)
4- Obecnie obliczane jest całkowita różnica energii swobodnej Gibbs Uzyskiwanie:
Dg = dh -tds -sdt = tds + vdp -tds -sdt
Gdzie DH został zastąpiony wyrażeniem znalezionym w (3).
5- Wreszcie, upraszczając, dostajesz: DG = VDP - SDT, Oczywiste jest, że energia swobodna g zależy od ciśnienia i temperatury t jako:
G = g (p, t)
- Relacje termodynamiczne Maxwella
Z analizy w poprzedniej sekcji wynika, że energia wewnętrzna systemu jest funkcją entropii i objętości:
U = u (s, v)
Następnie różnica LUB Być:
du = ∂SU |V DS + ∂VU |S DV = TDS - PDV
Na podstawie tego wyrażenia w częściowych pochodnych można wywnioskować relacje termodynamiczne Maxwell Maxwell. Pochodne częściowe obowiązują, gdy funkcja zależy od więcej niż jednej zmiennej i można je łatwo obliczyć, stosując twierdzenie z poniższej sekcji.
Pierwszy związek Maxwella
∂VT |S = -MonSP |V
Aby dotrzeć do tego związku, Twierdzenie Clairaut - Schwarz na częściowych pochodnych, które stwierdzają:
„Mieszane pochodne drugiego rzędu ze zmiennymi wymienionymi są takie same, pod warunkiem, że funkcje, które mają być wyprowadzone, są ciągłe i różniczne”.
Drugi związek Maxwella
Począwszy od tego, co zostało wykazane w 3 punkcie poprzedniej sekcji:
Może ci służyć: czynniki wpływające na rozpuszczalnośćH = H (S, P) i DH = TDS + VDP
Można uzyskać:
∂PT |S = ∂SV |P
Postępuj w podobny sposób z wolną energią Gibbs G = g (p, t) i z swobodną energią Helmholtza F = f (t, v) Aby uzyskać pozostałe dwa termodynamiczne relacje Maxwella.
 Rysunek 2. Josiah Gibbs (1839–1903) był amerykańskim fizykiem, chemikiem i matematykiem, który wniósł wielki wkład w termodynamikę. Źródło: Wikimedia Commons.
Rysunek 2. Josiah Gibbs (1839–1903) był amerykańskim fizykiem, chemikiem i matematykiem, który wniósł wielki wkład w termodynamikę. Źródło: Wikimedia Commons. Cztery relacje termodynamiczne Maxwella
1- Powiązane z energią wewnętrzną u: ∂VT |S = -MonSP |V
2- Ten uzyskany z entalpii h: ∂PT |S = ∂SV |P
3- związane z energią Helmholtza f: ∂TP |V = ∂VS |T
4- Połączone z energią swobodną Gibbsa G: ∂TV |P = -MonPS |T
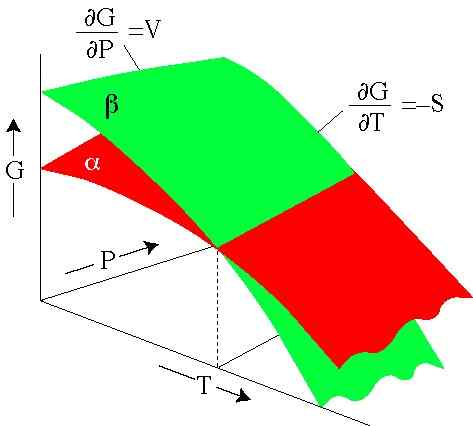 Rysunek 2. Energia Gibbsa zależy od ciśnienia i temperatury. Każda powierzchnia reprezentuje fazę. (SERC.Carleton.Edu)
Rysunek 2. Energia Gibbsa zależy od ciśnienia i temperatury. Każda powierzchnia reprezentuje fazę. (SERC.Carleton.Edu) Rozwiązane ćwiczenia
Ćwiczenie 1
Oblicz zmianę energii swobodnej GIBBS dla 2 moli idealnego gazu w temperaturze 300k podczas rozszerzenia izotermicznego, co prowadzi do początkowego systemu objętości 20 litrów do końcowej objętości 40 litrów.
Rozwiązanie
Pamiętając o definicji swobodnej energii Gibbsa:
G = h - t s
Wówczas skończona odmiana F będzie:
ΔG = ΔH - t δs, Ponieważ δT = 0
W gazach idealnych entalpia zależy tylko od jej temperatury bezwzględnej, ale ponieważ jest to proces izotermiczny, a następnie δH = 0 i ΔG = - t δs.
W przypadku gazów idealnych odmiana entropii procesu izotermicznego wynosi:
ΔS = nr ln (v2/V1)
To dotyczyło tego ćwiczenia:
ΔS = 2 mole x 8314 J/(k mol) x ln (40l/20l) = 11,53 J/k
Następnie możemy uzyskać zmianę energii Helmholtza:
ΔG = - 300K x 11,53 J/k = -3457,70 j.
Ćwiczenie 2
Biorąc pod uwagę, że energia swobodna GIBBS jest funkcją temperatury i ciśnienia g = g (t, p); Określić zmienność g podczas procesu, w którym temperatura się nie zmienia (izotermiczna) dla n moli idealnego gazu monoatomicznego.
Może ci służyć: wodorotlenek strontu (SR (OH) ₂)Rozwiązanie
Jak pokazano powyżej, zmiana energii Gibbsa zależy tylko od zmiany temperatury T i objętości V, więc jego nieskończenie małe zmienność jest obliczana zgodnie z:
Dg = -sdt + vdp
Ale jeśli jest to proces, w którym temperatura jest stała, wówczas df = + vdp, więc skończona zmienność ciśnienia δp prowadzi do zmiany energii gibbsa podanej przez:
ΔG = + ∫ Vdp = + ∫ (n r t) dp/p = + n r t ln (δp)
Korzystanie z równania gazu idealnego:
P v = n r t
Podczas procesu izotermicznego zdarza się, że:
D (p v) = p dv + v dp = 0
To jest:
dp/p = - dv/v
Więc poprzedni wynik można zapisać w zależności od zmienności objętościowej Δv:
ΔG = + ∫ Vdp = + ∫ (n r t) dp/p = - ∫ (n r t) dv/v = -n r t ln (δv)
Ćwiczenie 3
Biorąc pod uwagę następującą reakcję chemiczną:
N20 (g) + (3/2) lub2 (g) ↔️2 (g) W temperaturze t = 298 K
Znajdź zmianę energii swobodnej Gibbs i poprzez uzyskany wynik, wskazuj, czy jest to proces spontaniczny.
Rozwiązanie
Poniżej kroków:
- Pierwszy krok: entalpie reakcji
ΔHr = 2*δh (nie2 (g)) - ΔH (n20 (g)) = 2*33,2-81,6 = -15,2 kJ/mol
- Drugi krok: zmienność entropii reakcji
ΔSR = 2*s (nie2 (g)) - s (n20 (g)) - (3/2) s (lub2 (g)) = 2*240,1 - 220,1 - 1,5*205,2 = -47,7 j/(mol*k).
- Trzeci krok: Zmienność funkcji GIBBS
Ta wartość określi równowagę między zmniejszającą energią a rosnącą entropią, aby wiedzieć, czy reakcja jest wreszcie spontaniczna, czy nie.
ΔGR = ΔHr -t δSr = -15,2 -298*(-47,7) = -985,4 J/mol
Ponieważ jest to ujemna zmiana energii Gibbs, można stwierdzić, że jest to spontaniczna reakcja w temperaturze 298 k = 25 ºC.
Bibliografia
- Castaños e. Ćwiczenia energetyczne. Odzyskane z: lidiaconlachimica.WordPress.com.
- Cengel i. 2012. Termodynamika. 7. edycja. McGraw Hill.
- Librettexts. Bezpłatna energia Gibbs. Odzyskane z: chem.Librettexts.org
- Librettexts. Co to jest bezpłatna energia. Odzyskane z: chem.Librettexts.org
- Wikipedia. Bezpłatna energia Gibbs. Odzyskane z: jest.Wikipedia.com
- Wikipedia. Bezpłatna energia Gibbs. Źródło: w:.Wikipedia.com
- « Podstawy metody MOHR, reakcje, procedura,
- Koncepcja i charakterystyka systemów krystalicznych, typy, przykłady »

