Energia jonizacji

- 4891
- 1221
- Maksymilian Kępa
Co to jest energia jonizacyjna?
energia jonizacji, Reprezentowane przez symbol I, jest to minimalna ilość energii wymaganej do uruchomienia zewnętrznego elektronu do mola atomów w stanie gazowym, w jego podstawowym stanie. Innymi słowy, jest to minimalna ilość energii wymagana do przekształcenia mol atomów neutralnych w stan gazowy w mol jonów o obciążeniu dodatnim (stąd nazwa).
Widziane w postaci równania chemicznego energia jonizacji byłaby energią wymaganą do następującego procesu:
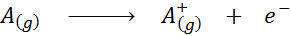
Energia jonizacyjna jest bezpośrednią miarą tego, jak silnie łączy się najbardziej zewnętrzne elektrony elementu chemicznego. Podczas definiowania energii procesu jonizacji stanu gazowego unika się wkładu lub zakłóceń interakcji międzycząsteczkowych występujących w stanach cieczy i stałej.
W ten sposób zapewnia, że energia jonizacji zależy tylko od wewnętrznych sił atomu, a w szczególności od stabilności elektronów, które tworzą warstwę walencyjną każdego elementu.
Proces usuwania elektronu z warstwy Walencji jest procesem wymagającym energii, więc jest to proces endotermiczny. Z tego powodu energie jonizacyjne są zawsze pozytywne (z konwencji, gdy energia wchodzi w system, jest uważany za pozytywny).
Istnieje więcej niż jedna energia jonizacji
Chociaż definicja energii jonizacji jest stosowana do neutralnych atomów, które stają się jonami dodatnimi (to znaczy kationami), można ją również zastosować do kolejnego usuwania dodatnich elektronów jonów, to znaczy gatunków, że już stracili elektrony.
W tym sensie energia jonizacji atomu neutralnego staje się tylko pierwszą z wielu możliwych energii jonizacji, ponieważ jest jeden dla każdego elektronu, który obraca się wokół jądra.
Może ci służyć: jakie są elementy ruchu?Innymi słowy, energie związane ze wszystkimi następującymi procesami są uważane za energie jonizacyjne:
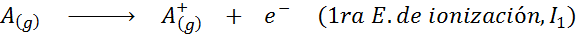
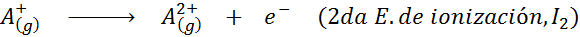
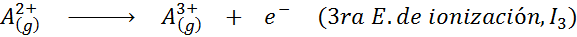
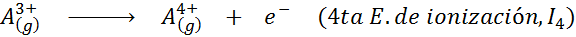
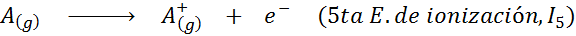
Kolejność kolejnych energii jonizacji
W przypadku każdego atomu dowolnego elementu wypełniono, że energia jonizacyjna będzie zawsze większa niż wszystkie poprzednie energie jonizacyjne. Innymi słowy, kolejne energie jonizacji mają następujący związek:
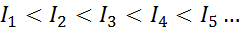
Powód, dla którego tak się dzieje, jest bardzo prosty. Pierwsza energia jonizacyjna polega na usunięciu elektronu do neutralnego atomu. Jednak druga energia jonizacji implikuje przeniesienie elektronu do atomu, który już stracił pierwszy.
Brak elektronu pozostawia dodatnie obciążenie netto, które przyciąga z większą wytrzymałością pozostałe elektrony, więc trudniej jest je uruchomić. Ponadto ta nieobecność zmniejsza również efekt osłony, jaki elektrony mają na najbardziej zewnętrzne elektron, więc jądro jest w stanie ich mocniej przyciągnąć.
W rezultacie trudniej jest uruchomić drugi elektron niż pierwszy i trudniej będzie uruchomić trzeci niż drugi itd., Jak można zobaczyć w następującej tabeli energii jonizacji dla pierwszych 10 elementów stołowy okresowy.
Z | Element | Pierwszy | Drugi | Trzeci | Kwartał | Piąty | Szósty |
1 | H | 1312 | |||||
2 | On | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Być | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | ALBO | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Okresowy trend energii jonizacji
Energia jonizacyjna jest właściwością okresową, która wzrasta od lewej do prawej i od dołu do tabeli okresowej, jak można zobaczyć na poniższej grafice.
Może ci służyć: rozszerzenie liniowe: co to jest, wzór i współczynniki, przykład
Zmienność I w ciągu dnia
Kiedy poruszamy się przez okres od lewej do prawej, stopniowo nazywane jest skuteczne obciążenie jądrowe, co jest niczym więcej niż prawdziwym obciążeniem dodatnim, które najbardziej zewnętrzne elektrony „widzą” z powodu tarczy najbardziej wewnętrznych elektronów.
Oznacza to, że siła, z jaką jądro jest w stanie przyciągnąć elektrony walencji, rośnie, więc trudniej jest je oderwać, a wymagana energia (to znaczy energia jonizacyjna) staje się większa.
Odmiana I w całej grupie
Po zejściu w grupie umieszczamy elektrony w rosnącym poziomie energii, a zatem w orbitalach atomowych coraz bardziej daleko od jądra. Z tego powodu siła, z jaką jądro przyciąga walence elektron.
Jak określić energię jonizacyjną?
Energia jonizacyjna jest eksperymentalnie pewną ilością poprzez serię technik zwanych razem, spektroskopia fotoelektronów.
Techniki te oparte są na zjawisku bardzo podobnym do efektu fotoelektrycznego, w którym promieniowanie elektromagnetyczne jest w stanie uruchomić elektrony atomu, a także różnica między energią promieniowania a energią kinetyczną, z którą wystrzeliwuje elektron, reprezentuje energię jonizacyjną energii jonizacji.
Różne techniki spektroskopii fotoelektronów pozwalają na analizę energii, których praktycznie każdy elektron jest powiązany z jej jądrem, czy to elektron walencji, czy elektron wewnętrzny.
Przykłady energii jonizacji
Pierwsze energie jonizacyjne gazów szlachetnych
Gazy szlachetne mają najbardziej stabilne konfiguracje elektroniczne wszystkich elementów tabeli okresowej. Z tego powodu mają również największe energie jonizacyjne. Pierwsza energia jonizacji każdego z gazów szlachetnych przedstawiono poniżej:
-
Hel
Jego pierwsza energia jonizacyjna wynosi 2373 kJ/mol, najwyższa w całej tabeli okresowej.
-
Neon
Jego pierwsza energia jonizacji wynosi 2080 kJ/mol i jest drugim najwyższym.
-
Argon
Jego pierwsza energia jonizacji wynosi 1521 kJ/mol. Tylko F, NE i on mają większe energie jonizacyjne.
-
Kripton
Pierwsza energia jonizacyjna to 1350 kJ/mol. Nie jest tak wysoki jak inne, ale wciąż jest większe niż jego sąsiednich elementów.
-
Ksenon
To samo, co mówi się o Kriptonie, można powiedzieć o ksenonie z jego pierwszą energią jonizacyjną wynoszącą 1170 kJ/mol.
Może ci służyć: dziura robaka: historia, teoria, typy, formacjaPierwsza i druga energia jonizacyjna metali alkalicznych
Z kolei metale alkaliczne mają najmniejszą pierwszą energię jonizacyjną i największą drugą energię jonizacyjną wszystkich elementów:
-
Lit
Jego pierwsza energia jonizacyjna jest mniejsza niż jedna czwarta energii HE, ale lit ma największą drugą energię jonizacyjną wszystkich elementów, która wynosi 7300 kJ/mol.
-
Sód
Sód bardzo łatwo traci swój pierwszy elektron, ponieważ nabywa konfigurację elektroniczną NE, ale aby wyeliminować drugi elektron, musisz dostarczyć 4560 kJ/mol.
-
Potas
Pierwsza energia jonizacji potasu wynosi tylko 418,7 kJ/mol, podczas gdy druga to 3052 kJ/mol, znacznie większa niż jego sąsiadów.
-
Rubid
Z energią jonizacji 403 kJ/mol, Rubidio jest jednym z elementów o mniejszej energii jonizacji. Jednak drugi to 2633 kJ/mol.
-
Cez
Jego pierwsza energia jonizacji wynosi tylko 375 kJ/mol, a druga 2234 kJ/mol, a nawet niższa niż pierwsza energia jonizacji helu.

