Silna koncepcja elektrolitu, charakterystyka, przykłady

- 1083
- 317
- Gabriela Łuczak
A Silny elektrolit To wszystko ta substancja rozpuszczona w wodzie lub w określonym rozpuszczalniku jest całkowicie zdysocjowana na jonach. Dlatego nie powinno być roztworu jako neutralnych cząsteczek lub jako nierozpuszczalnych ciał stałych. Silnym elektrolitem może być sól, kwas lub zasada, pod warunkiem, że dysocjują lub całkowicie jonowe.
Najbardziej reprezentatywnym przykładem elektrolitu jest wspólna sól, chlorek sodu, NaCl. W roztworze wodnym kryształy NaCl w całości w celu wytworzenia jonów NA+ i Cl-, które kończą się otaczającymi cząsteczkami wody. Następnie mówi się, że sól zachowuje się jak silny elektrolit, gdy jej rozpuszczalność jest bardzo wysoka w wodzie.
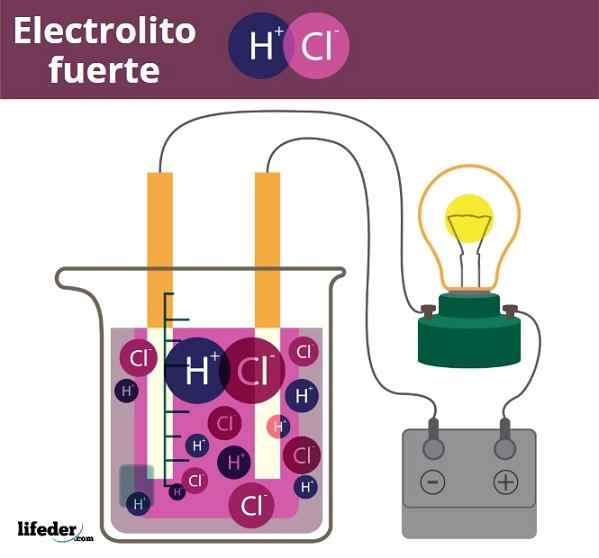 Przykład elektrolitowy Fuero. HCL, kwas solny, uwalnianie jonów H3O+ i CL-
Przykład elektrolitowy Fuero. HCL, kwas solny, uwalnianie jonów H3O+ i CL- Nieco podobny jest przypadek kwasów i podstaw. Gdy są one silne, ich roztwory w wodzie wytwarzają maksymalną możliwą ilość jonów H3ALBO+ lub och-, Więc zmiany pH są nagle. Przykładami silnych kwasów i zasad są kwas azotowy, HNO3, i odpowiednio wodorotlenek potasu, KOH.
Ważne jest, aby wiedzieć, jak zidentyfikować silne elektrolity podczas przygotowywania bardzo jonowych roztworów lub bardzo silnych kwasów lub podstawowych środków.
[TOC]
Charakterystyka silnych elektrolitów
Rozpuszczalność
Silne elektrolity charakteryzują się jako wyjątkowo rozpuszczalne substancje wodne. Niezależnie od tego, czy gazy, czy w kontakcie z wodą, nie należy go zbytnio opóźniać, aby całkowicie rozpuścić. Jeśli na przykład sól jest mało rozpuszczalna w wodzie, można odrzucić jako silny elektrolit.
Przewodność jonowa
Silne elektrolity są nie tylko bardzo rozpuszczalne w wodzie, ale także generują dużą liczbę jonów. Dzięki opłatom elektrycznym tych jonów elektrony mogą wygodnie podróżować po roztworach. Znajduje to odzwierciedlenie w zwiększeniu przewodnictwa jonowego w odniesieniu do czystej wody. Dlatego rozwiązania jonowe prowadzą bardzo dobrze energię elektryczną.
Może ci służyć: chlor: historia, właściwości, struktura, ryzyko, zastosowaniaNeutralność soli fizjologicznej
Wiele silnych elektrolitów soli fizjologicznej, podczas rozpuszczania się w wodzie, nie powoduje żadnej zmiany pH. Oznacza to, że roztwory tych soli nie są kwaśne ani podstawowe, ale neutralne, z pH blisko 7.
Mogą jednak istnieć kwas lub podstawowe sole, które można łatwo rozpuścić w wodzie, a także generują pełne jony. Na przykład węglan sodu2WSPÓŁ3, Rozpuszcza się w celu wygenerowania jonów NA+ i co32-, Ale pH rozwiązania jest podstawowe.
Przykłady silnych elektrolitów
 Chlorek sodu jest najbardziej reprezentatywnym przykładem silnego elektrolitu. Źródło: Cristian v. /CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)
Chlorek sodu jest najbardziej reprezentatywnym przykładem silnego elektrolitu. Źródło: Cristian v. /CC BY-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0) Silne elektrolity, będąc tak wieloma, są podzielone na trzy klasyfikacje: silne kwasy, silne zasady i rozpuszczalne sole iloczyn neutralizacji między pierwszymi dwoma.
Silne kwasy
Silne kwasy podczas rozpuszczania się w wodzie bez żadnego problemu muszą wytworzyć maksymalną możliwą ilość h3ALBO+, więc kwas musi być całkowicie jonem; Oznacza to, że nie powinna istnieć jako neutralna cząsteczka z protonami kwasu bez uwalniania.
Przykładami tych kwasów są:
-HCL, kwas solny, uwalnia H jony3ALBO+ i Cl-
-HF, kwas fluorowy, uwalnia ję3ALBO+ i f-
-Hno3, Kwas azotowy, uwalnia3ALBO+ i nie3-
-Hclo4, kwas perkloryczny, uwalnia ję3ALBO+ i Clo4-
-Hio4, Kwas okostowy, uwalnia ję3ALBO+ i io4-
-H2południowy zachód4, Kwas siarkowy, uwalnia3ALBO+ A więc42-
Powód, dla którego jon hydrium, h3ALBO+, Jest zawsze obecny (w taki czy inny sposób), ponieważ darowizny, który przekazują, jest odbierany przez cząsteczkę wody:
HCl + H2O → h3ALBO+ + Cl-
Reakcja jest bezpośrednia i nieodwracalna. Jest to charakterystyczne dla silnego kwasu, który z kolei jest silnym elektrolitem ze względu na pełną jonizację w wodzie.
Może ci służyć: węglowodory alifatyczne: właściwości, nomenklatura, reakcje, typySilne bazy
Silne podstawy, bez problemu rozpuszczające się w wodzie, muszą uwolnić jony OH- z tych samych kryształów lub nieodwracalnie nie do zniesienia cząsteczki wody, aby.
Wiele silnych zasad składa się z jonów i nieogączkowych stałych. Niektóre przykłady tych podstaw, które zachowują się jako silne elektrolity, to:
-Lioh, wodorotlenek litu, uwalnia jony OH- i Li+
-NaOH, wodorotlenek sodu, uwalnia jony OH- i na+
-RBOH, wodorotlenek Rubidio, uwalnia jony- i RB+
-CA (OH)2, wodorotlenek wapnia, uwalnia- i CA2+
-SR (OH)2, Wodorotlenek strontu, uwalnia- i panie2+
-BA (OH)2, wodorotlenek baru, uwalnia- i BA2+
-Nah, wodork sodu, uwalnia jony- i gaz wodorowy, H2
-Nanh2, sód obmiła, uwolnij jony- i gaz amoniaku, NH3
Ty wyjdź
Hallobasi silne elektrolity podczas rozpuszczania się w wodzie muszą być całkowicie jonem. Wiele z nich nie powoduje zmian pH. Jest tak, ponieważ ich jony są bardzo stabilne, więc nie uczestniczą w saldach hydrolizy, aby zmienić charakter wody. Przykładami tych soli są:
-NaCl, chlorek sodu, uwalnia jony NA+ i Cl-
-Agno3, Azotan srebra, uwalniające jony AG+ i nie3-
-Starszy brat3, azotan sodu, uwalniają jony NA+ i nie3-
-K2południowy zachód4, siarczan potasu, uwalnia k jony+ A więc42-
-MGCL2, Chlorek magnezu, uwalnia jony MG2+ i Cl-
-Cuso4, Siarczan miedzi, uwalnia jony cu2+ A więc42-
-KBR, bromek potasowy, uwalnia k jony+ i br-
-NH4CL, chlorek amonu, uwalnia jony NH4+, Cl-, H3ALBO+ i gaz amoniaku
Może ci służyć: chlorek rtęci (ii): struktura, właściwości, uzyskiwanie, użycia-Nacn, cyjanku sodu, uwalnia jony NA+ i Cn-
-Na3PO4, Fosforan sodu uwalnia jony NA+ i Po43-
-Crcl3, Chlorek chromowy uwalnia jony CR3+ i Cl-
-Aub3, Bromide aury, uwalnia jony au3+ i br-
-SNSO4, Estany siarczan, uwalnia jony SN2+ A więc42-
NH4CL jest sprzecznym przykładem: jest całkowicie zjonizowany, ale jednocześnie generuje neutralne cząsteczki amoniaku, ponieważ jest to kwasowy sól.
Różnice między silnym i słabym elektrolitem
Chociaż różnice między silnym elektrolitem słabego zostały pośrednie ustalone, zostaną one przedstawione poniżej jako wniosek:
-Silne elektrolity są bardzo rozpuszczalne w wodach; Słabe elektrolity nie są.
-Jonizacja słabego elektrolitu jest częściowa, co oznacza, że w roztworze mogą występować neutralne cząsteczki. Zamiast tego silne elektrolity istnieją wyłącznie jako jony.
-Słabe kwasy i zasady, które z kolei są słabymi elektrolitami, nie dysocjują się całkowicie w wodzie, więc generują mniej jonów h3ALBO+ lub och- Czego można się spodziewać.
-Mocne elektrolity halth -halina są prawie hydrolizowane w porównaniu ze słabymi elektrolitami. Dlatego roztwory tego pierwszego są neutralne, z wyjątkiem sytuacji, gdy radzą sobie z soli kwasowych lub podstawowych.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Silny elektrolit. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Silna definicja elektrolitów i przykład. Odzyskane z: Thoughtco.com
- Chung & Chieh. (5 czerwca 2019). Elektrolity. Chemia librettexts. Odzyskane z: chem.Librettexts.org

