Struktura disiarczku węgla (CS2), właściwości, zastosowania, ryzyko
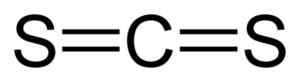
- 1761
- 123
- Bertrand Zawadzki
On Disiarczde węglowe Jest to związek utworzony przez połączenie atomu węgla (C) i dwóch atomów siarki (ów). Jego formuła chemiczna to CS2. Jest to bezbarwna lub lekko żółta ciecz o nieprzyjemnym zapachu z powodu zanieczyszczeń, które zawiera (związki siarki). Kiedy czysty jego zapach jest miękki i słodki, podobny do chloroformu lub eteru.
Naturalnie wywodzi się z działania światła słonecznego na cząsteczkach organicznych występujących w wodzie morskiej. Ponadto występuje w wodach bagnach, a także jest wydalany z wulkanów wraz z innymi gazami.
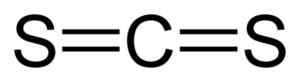 Disiarczk węglowy CS2. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Disiarczk węglowy CS2. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Disiarczde węglowe jest płynem lotnym i jest również bardzo łatwopalne, więc należy go trzymać z dala od płomieni i iskry lub urządzeń, które mogą je wytwarzać, w tym żarówki elektryczne.
Ma zdolność rozpuszczenia dużej liczby związków, materiałów i pierwiastków, takich jak fosfor, siarka, selen, żywice, lakiery itp. Dlatego uważa użyteczność jako rozpuszczalnik.
Jest także pośrednikiem w różnych przemysłowych reakcjach chemicznych, takich jak produkcja Rayon lub sztuczny jedwab.
Musi być manipulowany ostrożnością i narzędziami ochrony, ponieważ jest bardzo toksyczny i niebezpieczny.
[TOC]
Struktura
Disiarczde węglowe ma atom węglowy i dwa atomy siarki po bokach tego.
Połączenia między atomem węgla a atomami siarki są kowalencyjne i podwójne, dlatego są bardzo silne. Cząsteczka CS2 Ma strukturę liniową i symetryczną.
 Liniowa struktura disiarczku węgla CS2. Czarny = węgiel, żółty = siarka. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Liniowa struktura disiarczku węgla CS2. Czarny = węgiel, żółty = siarka. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Nomenklatura
- Disiarczde węglowe
- Bisiczos węglowy
- Bezwodnik ditiokarboniczny
Nieruchomości
Stan fizyczny
Bezbarwny do żółtawej.
Waga molekularna
76,15 g/mol
Punkt fuzji lub zestalania
-110,8 ° C
Punkt wrzenia
46,0 ° C
Temperatura zapłonu
-30 ° C (metoda zamkniętej kubka).
Temperatura samo -kierunkowego
90 ° C
Gęstość
Ciecz = 1,26 g/cm3 w 20 ° C.
Para = 2,67 razy powietrze.
Jego opary są ponad podwójnie ciężkie niż powietrze, a płyn jest cięższy niż woda.
Ciśnienie pary
279 mmHg w 25 ° C.
Może ci służyć: hipochloryt potasowy (KCLO)To jest wysokie ciśnienie pary.
Rozpuszczalność
Bardzo mało rozpuszczalnych w wodzie: 2,16 g/l A 25 ° C. Rozpuszczalne w chloroformu. Mamiczne z etanolem, metanolem, eterem, benzenem, chloroformem i tetrachlorkiem węgla.
Właściwości chemiczne
Cs2 Łatwo odparowuje w temperaturze pokojowej, ponieważ jego temperatura wrzenia jest bardzo niska, a jego ciśnienie pary jest bardzo wysokie.
Disiarczde węglowe jest wyjątkowo łatwopalne. Jego opary są bardzo łatwo zapalone, nawet z ciepłem żarówki elektrycznej. Oznacza to, że bardzo szybko reaguje z tlenem:
Cs2 + 3 o2 → CO2 + 2 Tak2
Fakt, że masz wysokie ciśnienie pary w temperaturze pokojowej, sprawia, że jest niebezpieczne, by być blisko płomienia.
Po podgrzaniu do rozkładu może łatwo wykorzystać, emitując toksyczne gazy z tlenków siarki. Powyżej 90 ° C jest włączony spontanicznie.
Rozkłada się, gdy jest przechowywany przez długi czas. Atakuj miedź i jego stopy. Reaguje również z niektórymi tworzywami sztucznymi, gumami i powłokami.
Reaguje w określonych warunkach z wodą, tworząc OCS siarkowbaszek, dwutlenek węgla CO2 i disiarczka wodoru H2S:
Cs2 + H2O → OCS + H2S
Cs2 + 2 godz2O → co2 + 2 godz2S
Z alkoholami (ROH) w pożywce alkalicznej tworzą się xantates (RO-CS-NNA):
Cs2 + ROH + NaOH → H2Lub + ro -c (= s) -SNA
Uzyskanie
Disiarczd węglowy jest wytworzony na rynku przez reakcję siarki z węglem. Proces przeprowadzany jest w temperaturach 750-900 ° C.
C + 2 S → CS2
Zamiast węgla możesz również użyć metanu lub gazu ziemnego, a nawet etan, propan i propylen, w którym to przypadku reakcja zachodzi w temperaturze 400-700 ° C z wysoką wydajnością.
Można go również przygotować przez reakcję gazu ziemnego z siarczkiem wodoru H2S bardzo wysoka temperatura.
Obecność w naturze
Cs2 Jest to naturalny produkt obecny w atmosferze w bardzo małych ilościach (ślady). Występuje fotochemicznie w wodach powierzchniowych.
Działanie światła słonecznego na niektóre związki obecne w wodzie morskiej, takie jak cysteina (aminokwas), prowadzi do tworzenia disiarczku węgla.
 Disiarczde węglowe można utworzyć przez działanie promieni słonecznych na niektóre związki organiczne obecne w wodzie morskiej. Autor: Pexels. Źródło: Pixabay.
Disiarczde węglowe można utworzyć przez działanie promieni słonecznych na niektóre związki organiczne obecne w wodzie morskiej. Autor: Pexels. Źródło: Pixabay. Jest również naturalnie uwalniany podczas erupcji wulkanicznych i występuje w małych ilościach na bagnach.
Może ci służyć: benzaldehydZwykle jesteśmy narażeni na oddychanie w bardzo małych proporcjach i jest obecne w niektórych potrawach. Znajduje się również w dymie papierosów.
W środowisku rozkłada się przez światło słoneczne. Na ziemi porusza się przez niego. Niektóre mikroorganizmy gleby rozpadają się.
Aplikacje
W przemyśle chemicznym
Disiarczde węglowe jest ważnym związkiem chemicznym, ponieważ służy do przygotowania innych chemikaliów. Może działać jako chemiczne pośrednie.
Jest również stosowany na przykład jako rozpuszczalnik procesowy do rozpuszczenia fosforu, siarki, selenu, bromu, jodu, tłuszczów, żywic, wosków, lakierów i gumów.
Umożliwia między innymi produkcję produktów farmaceutycznych i herbicydów.
W produkcji Rayón i Celofána
Z CS2 Przygotowane są xantatos, które są związkami stosowanymi w produkcji Rayón i Celofán.
Aby uzyskać sztuczny jedwab lub rayon, opiera się na celulozie, która jest traktowana alkaliami i dwusiarczkiem węglowym CS2 i przekształca się w celulozę xantate, rozpuszczalne w alkaliach. To rozwiązanie jest lepkie i dlatego nazywa się „Viscosa”.
Wiskoza jest wytwarzana pod ciśnieniem przez bardzo małe otwory w kąpieli kwasowej. Tutaj ksantan celulozy jest ponownie przekształcany w celulozę, która jest nierozpuszczalna, a długie i jasne nici.
Wątki lub włókna można obrócić, aby dać materiał znany jako Rayón.
(1) celuloza + NaOH → Alkalia-CELOSA
ROH + NaOH → Rona
(2) Alkali-kółka + disiarczde węglowe → celuloza xantan
Rona + s = c = s → ro -c (= s) -SNA
(3) xantate celulozy + kwasu → celulozy (włókna)
RO -C (= S) -SNA + kwas → ROH
 Odzież wykonana z Rayon, błonnik, którego produkcja uczestniczy disiarczki węglowe. Tobias „Weź” Maier [CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Odzież wykonana z Rayon, błonnik, którego produkcja uczestniczy disiarczki węglowe. Tobias „Weź” Maier [CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Jeśli celuloza zostanie wytrącona przez przepuszczenie xantato przez wąskie szczelinę, celuloza jest regenerowana w postaci cienkich arkuszy tworzących celofan. Jest to zmiękczone glicerolem i jest używane jako obiektowy film ochronny.
 Celofan jest wytwarzany za pomocą disiarczku węgla. Autor: Hans Braxmeier. Źródło: Pixabay.
Celofan jest wytwarzany za pomocą disiarczku węgla. Autor: Hans Braxmeier. Źródło: Pixabay. W produkcji tetrachlorku węglowego
Disiarczde węglowe reaguje z chlorem CL2 Aby podać czterochlorek węglowy CCL4, który jest ważnym rozpuszczalnikiem, który nie jest paliwem.
Może ci służyć: chlorobenzen (C6H5CL)Cs2 + 3 cl2 → CCl4 + S2Cl2
W kilku aplikacjach
Disiarczde węglowe uczestniczy w zimnej wulkanizacji gumy.
Xantatos przygotowane z CS2 Są one używane w flotacji mineralnej.
Stare zastosowania
Cs2 To trucizna dla żywych organizmów. Wcześniej był używany do niszczenia szkodników, takich jak szczury, świnki i mrówki, wylewając ciecz w każdej zamkniętej przestrzeni, w której mieszkają te zwierzęta (nory i hormigueros))).
Kiedy w tym celu użyto gęstych toksycznych oparów, zakończyły każdy żywy organizm, który był w ograniczonej przestrzeni.
Był również stosowany jako przeciwgą na zwierzęta i do eliminowania larw z moscardonów z żołądka koni.
W rolnictwie stosowano go jako owadobójczy i nematydowy, do fumigacji gleby, fumigacji szkółek, stodołów, silosów i młynów zbóż. Fumigowano również wagony, statki i barki.
 Farmer w 1904 r. Fumigując glebę disiarczkiem węglowym w celu zwalczania zarazy roślin winogron. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu antylopa.Org/licencje/stare licencje/FDL-1.2.html)]. Źródło: Wikimedia Commons.
Farmer w 1904 r. Fumigując glebę disiarczkiem węglowym w celu zwalczania zarazy roślin winogron. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu antylopa.Org/licencje/stare licencje/FDL-1.2.html)]. Źródło: Wikimedia Commons. Wszystkie te zastosowania były zabronione z powodu wysokiej łatwości i toksyczności CS2.
Ryzyko
Cs2 Jest bardzo łatwopalny. Wiele twoich reakcji może powodować ogień lub eksplozję. Mieszanki ich oparów z powietrzem są wybuchowe. Podczas zapalenia powoduje drażniące lub toksyczne gazy.
Disiarczde węglowe dla drenów nie należy wlać, ponieważ w probówkach występuje mieszanka CS2 i powietrze, które może spowodować eksplozję, jeśli jest oświetlona przez przypadek.
Jego opary strzelają spontanicznie w kontakcie z iskry lub gorącymi powierzchniami.
Disiarczde węglowe poważnie podrażnia oczy, skórę i błony śluzowe.
Jeśli ośrodkowy układ nerwowy jest wdychany lub połknięty poważnie, układ sercowo -naczyniowy, oczy, nerki i wątroba. Można go również wchłonąć przez skórę, powodując uszkodzenia.
Bibliografia
- LUB.S. National Library of Medicine. (2020). Węgiel disiarczkowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Mopper, k. I Kieber, D.J. (2002). Fotochemia i cykl węgla, siarki, azotu i pospherus. W biogeochemiczności morskiej rozpuszczonej materii organicznej. Odzyskane z naukowym.com.
- Meyer, ur. (1977). Przemysłowe zastosowania siarki i jej kompondentów. Węgiel disiarczkowy. W siarce, energii i zazdrości. Odzyskane z naukowym.com.
- Pohanish, r.P. (2012). C. Węgiel disiarczkowy. W podręczniku Sittig z toksycznych i niebezpiecznych chemikaliów i rakotwórczych (wydanie szóste). Odzyskane z naukowym.com.
- Morrison, r.T. i Boyd, r.N. (2002). Chemia organiczna. 6. edycja. Prentice-Hall.
- Windholz, m. i in. (redaktorzy) (1983). Indeks Merck. Enyklopedia chemikaliów, leków i biologicznych. Wydanie dziesiąte. Merck & Co., Inc.
- « 95 najlepszych wyrażeń katolickich świętych
- +105 Zwroty katolickie dotyczące wiary, refleksji, modlitwy i nadziei »

