Różnice między związkami organicznymi i nieorganicznymi

- 3081
- 519
- Bertrand Zawadzki
Różnice między związkami organicznymi i nieorganicznymi Nie zawsze są proste, ani nie są przestrzegane niezmienna zasada, ponieważ pod względem chemii istnieją symfiny wyjątków, które są sprzeczne z poprzednią wiedzą. Istnieją jednak cechy, które pozwalają rozróżnić wiele związków, które lub nie nieorganiczne.
Z definicji chemia organiczna to badanie obejmujące wszystkie gałęzie chemii węgla; Dlatego logiczne jest myślenie, że ich szkielety składają się z atomów węgla. Z drugiej strony szkielety nieorganiczne (bez wchodzenia do polimerów) zwykle składają się z jakiegokolwiek innego elementu układu okresowego innego niż węgiel.
Żywe istoty, we wszystkich ich skalach i wyrażeniach, są praktycznie wykonane z węgla i innych heteroátomos (H, O, N, P, S itp.). Tak więc cała zieleń, która obejmuje skorupę Ziemi, a także stworzenia, które na nią chodzą, są żyjącymi przykładami kompleksowych związków organicznych i dynamicznie.
Z drugiej strony wiercenie Ziemi i w górach znajdujemy bogate ciała mineralne w składach i kształtach geometrycznych, które w ich zdecydowanej większości są związkami nieorganicznymi. Te ostatnie definiują również prawie całkowicie atmosferę, którą oddychamy, a oceany, rzeki i jeziora.
Związki organiczne | Związki nieorganiczne | |
Atomy, które to komponują | Zawierają atomy węgla. | Składają się z pierwiastków innych niż węgiel. |
Są częścią .. | Są częścią żywych istot. | Są częścią obojętnych istot. |
Źródła, w których są | Są mniej obfite w naturalnych źródłach. | Są bardziej obfite w naturalnych źródłach. |
Rodzaje związków | Zwykle są molekularne. | Zazwyczaj są jonowe. |
Rodzaje linków | Kowalencyjne linki. | Linki jonowe. |
Masy molowe | Większe masy trzonowe. | Niższe masy trzonowe. |
Różnorodność | Są mniej zróżnicowane. | Są bardziej różnorodnymi elementami. |
Punkty fuzji i wrzenia | Drobne punkty fuzji i wrzenia. | Wyższe punkty fuzji i gotowania. |
Główne różnice między związkami organicznymi i nieorganicznymi
Związki nieorganiczne są uzyskiwane z naturalnych źródeł bardziej obfite niż w przypadku związków nieorganicznych
 Kryształy cukru (po prawej) i sól (po lewej) widoczne w mikroskopie. Źródło: Oleg Panichev [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Kryształy cukru (po prawej) i sól (po lewej) widoczne w mikroskopie. Źródło: Oleg Panichev [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Chociaż mogą istnieć wyjątki, związki nieorganiczne są zwykle uzyskiwane z naturalnych źródeł bardziej obfite niż dla związków organicznych. Ta pierwsza różnica prowadzi do pośredniego stwierdzenia: związki nieorganiczne są bardziej obfite (na ziemi i w kosmosie) niż związki organiczne.
Oczywiście w miejscu oleju dominują węglowodory i powiązane dominujące, które są związkami organicznymi.
Wracając do sekcji, można go wymienić w soli cukrowej jako przykład. Kryształy cukru (bardziej solidne i fasetowane) i sól pokazano powyżej (mniejsze i zaokrąglone).
Cukier uzyskuje się po serii procesów z plantacji trzciny cukrowej (w regionach słonecznych lub tropikalnych) i buraków cukrowych (w zimnych regionach lub na początku zim lub jesieni). Oba są naturalnymi i odnawialnymi surowcami, które są uprawiane aż do ich odpowiednich zbiorów.
Może ci służyć: standaryzacja rozwiązańTymczasem sól pochodzi z znacznie bardziej obfitego źródła: morza lub jezior i soli, takich jak mineral Halita (NaCl). Gdyby zebrano wszystkie trzciny cukrowe i cukru, nigdy nie mogłyby dopasować się do naturalnych rezerw soli.
Kryształy nieorganiczne są zwykle jonowe, podczas gdy kryształy organiczne są zwykle molekularne
Przykładając parę cukru jako przykład, wiemy, że cukier składa się z disacharydu zwanego sacharozą, który z kolei rozpada się w jednostkę glukozy i drugą fruktozę. Kryształy cukru są molekularne, ponieważ są one zdefiniowane przez sacharozę i ich międzycząsteczkowe mosty wodorowe.
Tymczasem kryształy soli stanowią sieć na jonach+ i Cl-, które definiują strukturę sześcienną wyśrodkowaną na twarzach (FCC).
Centralnym punktem jest to, że związki nieorganiczne zwykle tworzą kryształy jonowe (a przynajmniej posiadające wysoki charakter jonowy). Istnieje jednak kilka wyjątków, takich jak kryształy CO2, H2S, więc2 oraz inne gazy nieorganiczne, które zestalają się w niskich temperaturach i wysokich ciśnieniach, a także są molekularne.
Woda stanowi najważniejszy wyjątek od tego punktu: lód to kryształ nieorganiczny i molekularny.
 Kilka śniegu lub lodu to kryształy wody, doskonałe przykłady nieorganicznych kryształów molekularnych. Źródło: Sieverschar de Pixabay.
Kilka śniegu lub lodu to kryształy wody, doskonałe przykłady nieorganicznych kryształów molekularnych. Źródło: Sieverschar de Pixabay. Minerały są w istocie związkami nieorganicznymi, a ich kryształy mają zatem głównie jonowy charakter. Dlatego ten drugi punkt jest uważany za ważny dla szerokiego spektrum związków nieorganicznych, w tym soli, siarczków, tlenków, tellurów itp.
Rodzaj łącza, który rządzi w związkach organicznych, jest kowalencyjny
Te same kryształy cukru i soli pozostawiają coś pytania: pierwsze zawierają łącza kowalencyjne (kierunkowe), podczas gdy drugie połączenia jonowe (nie -kierunkowe) (nie -kierunkowe).
Ten punkt jest bezpośrednio skorelowany z drugim: kryształ molekularny musi koniecznie mieć wiele wiązań kowalencyjnych (dzieląc kilka elektronów między dwoma atomami).
Ponownie, sole organiczne ustalają pewne wyjątki, ponieważ mają również silnie jonowy charakter; Na przykład benzoan sodu (c6H5Pata) to sól organiczna, ale w obrębie benzoanu i jego aromatycznego pierścienia są kowalencyjne wiązania. Mimo to mówi się, że ich kryształy są jonowe, biorąc pod uwagę interakcję elektrostatyczną: C6H5Gruchać- Na+.
W związkach organicznych, kowalencyjne wiązania między atomami węgla dominują
Lub to samo do powiedzenia: związki organiczne składają się z szkieletów gazowanych. W nich istnieje więcej niż jedno wiązanie C-C lub C-H, a ten szkielet może być liniowy, srekowy lub rozgałęziony, zmieniający się pod względem stopnia ich nienasycenia i rodzaju podstawnika (heteroaátomos lub grupy funkcjonalne). W linkach cukru, c-c, c-h i c-oh.
Może ci służyć: Zmniejszenie agenta: koncepcja, najsilniejsze, przykładyPostawmy jako przykład CO, rozdz2Och2 i H2C2ALBO4. Które z tych trzech związków są nieorganiczne?
W rozdz2Och2 (Dwutlenek etylenu) Istnieją cztery wiązania C-H i dwa łącza C-O, podczas gdy w H H2C2ALBO4 (kwas szczawiowy) Istnieje jeden C-C, dwa C-OH i dwa C = O. Struktura H2C2ALBO4 Można go napisać jako Hooc-Cooh (dwie połączone grupy karboksylowe). Tymczasem CO składa się z cząsteczki zwykle reprezentowanej z wiązaniem hybrydowym między C = O i C≡O.
Ponieważ w CO (tlenek węgla) istnieje tylko atom węgla związany z tlenem, gaz ten jest nieorganiczny; Pozostałe związki są organiczne.
Związki organiczne zwykle mają większe masy trzonowe
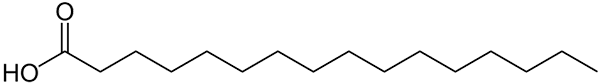 Struktura reprezentowana za pomocą linii kwasu palmitynowego. Wielka rzecz, która jest porównywana z mniejszymi związkami nieorganicznymi lub wzór jego soli. Źródło: Wolfgang Schaefer [domena publiczna]
Struktura reprezentowana za pomocą linii kwasu palmitynowego. Wielka rzecz, która jest porównywana z mniejszymi związkami nieorganicznymi lub wzór jego soli. Źródło: Wolfgang Schaefer [domena publiczna] Ponownie, istnieje wiele wyjątków od tych zasad, ale zwykle związki organiczne mają większe masy trzonowe z powodu karbonijnego szkieletu.
Na przykład zęby trzonowe powyższych związków to: 28 g/mol (CO), 90 g/mol (H (H (H2C2ALBO4) i 60 g/mol (wybierz2Och2). Oczywiście CS2 (Disiarczde węglowe), związek nieorganiczny i masa molowa wynosi 76 g/mol, „waży” więcej niż cho2Och2.
Ale co z tłuszczami lub kwasami tłuszczowymi? Biomolekuł, takich jak DNA lub białka? Lub rozległe węglowodory łańcucha liniowego? Lub asfalten? Jego masy trzonowe łatwo przekraczają 100 g/mol. Na przykład kwas palmitynowy (górny obraz) ma ciasto molowe o mocy 256 g/mol.
Związki organiczne są bardziej obfite
Niektóre związki nieorganiczne, zwane kompleksami koordynacyjnymi, przedstawiają Isomeía. Jest to jednak mniej zróżnicowane w porównaniu z izomerią organiczną.
Nawet jeśli dodamy wszystkie sole, tlenki (metaliczne i nie -metalowe), siarki, telururos, węgliki, wodorki, azotki itp., Nie gromadzilibyśmy być może nawet połowy związków organicznych, które mogą istnieć w naturze. Dlatego związki organiczne są bardziej obfite w liczbie i bogatsze w strukturach.
Związki nieorganiczne są podstawowe bardziej zróżnicowane
Jednak według różnorodności elementarnej związki nieorganiczne są bardziej zróżnicowane. Ponieważ? Ponieważ z okresowym stołem w dłoni można zbudować dowolny rodzaj związku nieorganicznego; podczas gdy związek organiczny jest ograniczony tylko do pierwiastków: C, H, O, P, S, N i X (halogeny).
Mamy wiele metali (alkalicznych, alkalinicznych, przejściowych, lantanowców, aktynidów, bloku P) i nieskończoności opcji połączenia ich z kilkoma anionami (zwykłymi nieorganicznymi); takie jak: co32- (Węglany), CL- (Chlorki), str3- (fosfuros), lub2- (tlenki), OH- (wodorotlenki), więc42- (siarczany), CN- (cyjanki), SCN- (Tiocianaty) i wiele innych.
Zauważ, że aniony CN- i Scn- Wydają się być organiczne, ale w rzeczywistości są nieorganiczni. Kolejnym zamieszaniem jest anion szczawiany, c2ALBO42-, który jest ekologiczny i nieinorganiczny.
Może ci służyć: reguła przekątnaZwiązki nieorganiczne mają wyższe punkty fuzji i wrzenia
Ponownie istnieje kilka wyjątków od tej reguły, ponieważ wszystko zależy od tego, która para związków jest porównywana. Jednak, trzymając się soli nieorganicznych i organicznych, te pierwsze zwykle mają większe punkty fuzji i wrzenia niż drugie.
Tutaj znajdujemy kolejny niejawny punkt: sole organiczne są podatne na rozkładanie się, ponieważ ciepło łamie kowalencyjne wiązania. Mimo to porównujemy partrato partrato (CAC4H4ALBO6) i węglan wapnia (CACO3). CAC4H4ALBO6 Rozkłada się w 600 ° C, a kako3 Topi się w 825 ° C.
I że kako3 jest dalekie od bycia jedną z soli o najwyższych punktach topnienia, jak w przypadku CAC2 (2160 ° C) i CAS2 (2525 °.
Związki organiczne są rzadsze we wszechświecie
Najprostsze i najbardziej prymitywne związki organiczne, takie jak metan, cho4, Mocz, co (NH2)2, lub glikina aminokwasowa, NH2Ch2COOH, są bardzo rzadkimi gatunkami w kosmosie w porównaniu do amoniaku, dwutlenku węgla, tlenków tytanu, węgla itp. We wszechświecie nawet materiały życia prekursorowe nie są często wykrywane.
Związki organiczne wspierają życie w znacznie większym stopniu niż nieorganiczne
 Skorupa Morroya składa się z mieszanki kości pokrytych keratyną, które składają się z matrycy nieorganicznej (hydroksyapatyt i powiązane minerały) i organiczne (kolagen, chrząstka i nerwy). Źródło: Morroy_ (Geochelone_carbonary).JPG: The Photography.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Skorupa Morroya składa się z mieszanki kości pokrytych keratyną, które składają się z matrycy nieorganicznej (hydroksyapatyt i powiązane minerały) i organiczne (kolagen, chrząstka i nerwy). Źródło: Morroy_ (Geochelone_carbonary).JPG: The Photography.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Chemia węgla, organiczna, stosowana w rozumieniu procesów metabolicznych, staje się biochemia (i z punktu widzenia kationów metalowych w bioinorganicznym).
Związki organiczne są kamieniem węgielnym życia (takiego jak Morroya górnego obrazu), dzięki łączom C-C i ogromnym konglomeratowi struktur wynikających z tych powiązań oraz z jego interakcją z kryształami soli nieorganicznych.
Wracając do pary cukru, naturalne źródła cukru żyją: są to uprawy, które się rozwijają i umierają; Ale nie zdarza się to tak samo ze źródłami soli: morza lub złoża soli fizjologicznej żyją (w sensie fizjologicznym).
Rośliny i zwierzęta syntetyzują niekończące się związki organiczne, które integrują szeroką gamę naturalnych produktów (witaminy, enzymy, hormony, tłuszcze, barwniki itp.).
Nie możemy jednak pominąć faktu, że woda jest rozpuszczalnikiem życia (i jest nieorganiczna); Ani tlen nie jest niezbędny do oddychania komórkowego (bez nazywania metalowych kofaktorów, które nie są związkami nieorganicznymi, ale kationami). Dlatego nieorganiczna odgrywa również kluczową rolę w definicji życia.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Helmestine, Anne Marie, pH.D. (3 lipca 2019). Różnica między organicznym i nieorganicznym. Odzyskane z: Thoughtco.com
- Texas Education Agency. (2019). Organiczne lub nieorganiczne? Odzyskane z: Texasgateway.org
- Sacharoza. (S.F.). Jak powstaje cukier: wprowadzenie. Odzyskane z: sukosa.com
- Wikipedia. (2019). Lista związków nieorganicznych. Źródło: w:.Wikipedia.org
- « Różnice między prędkością i prędkością (z przykładami)
- 10 Dynamika inteligencji emocjonalnej dla dzieci i dorosłych »

