Właściwości Dibenzalacetona, mechanizm reakcji, zastosowania, ryzyko

- 2594
- 360
- Eliasz Dubiel
Dibenzalacetona (DBA) to związek organiczny, którego wzór molekularny wynosi C17H14ALBO. Jest to żółtawo stałe, które w zależności od jego czystości można przedstawić jako kryształy. Jest stosowany w kremach przeciwsłonecznych i syntezie organetalicznej, w której palad jest używany jako katalizator.
Chociaż jego synteza jest stosunkowo prostym, dość powtarzającym się procesem w nauczaniu laboratoriów w celu wyjaśnienia kondensacji aldolicznej, jego mechanizm jest nieco obszerny, należy wziąć pod uwagę kilka czynników. Zastosowany benzaldehyd, który będzie skondensowany z acetonem, musi być nowo destylowany, aby zagwarantować jego niskie utlenianie w kontakcie z powietrzem.
 Próbka Dibenzalacetona w szklanym pojemniku. Źródło: Stephanb [CC BY-SA (http: // CreativeCommons.Org/licencje/by-sa/3.0/]]
Próbka Dibenzalacetona w szklanym pojemniku. Źródło: Stephanb [CC BY-SA (http: // CreativeCommons.Org/licencje/by-sa/3.0/]] Podobnie pożywka etanol-woda służy do leniwizowania odczynników, a jednocześnie promować ostateczne wytrącanie dibenzalacetonu, hydrofobowego i nierozpuszczalnego związku. Jak dotąd nie wiadomo, jakie negatywne skutki mogą ćwiczyć Dibenzalaceton na organizm lub środowisko, zamiast być podrażniającą substancją.
[TOC]
Nieruchomości
Wygląd fizyczny
Stały żółty zakurzony lub krystaliczny wygląd.
Masa cząsteczkowa
234,29 g/mol
Izomery
Dibenzalaceton jest przedstawiany jako trzy geometryczne izomery: trans-trans-trans-cis i cis-cis. Izomer trans-trans jest najbardziej stabilny, a zatem ten, który występuje najwięcej podczas syntezy.
Temperatura topnienia
110-111 ºC. Zakres ten różni się w zależności od stopnia czystości zsyntetyzowanego stałego.
Rozpuszczalność wody
Nierozpuszczalny.
Struktura
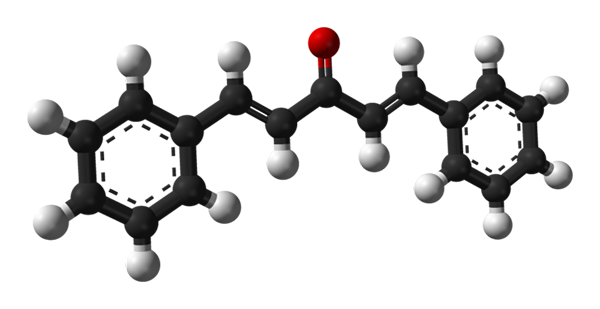 Struktura molekularna dibenzalacetonu. Źródło: Benjah-BMM27 [domena publiczna]
Struktura molekularna dibenzalacetonu. Źródło: Benjah-BMM27 [domena publiczna] Na górnym obrazie pokazano cząsteczkę izomeru trans-trans-trans. W środku mamy grupę karbonylową i po bokach, podwójne wiązania i dwa aromatyczne pierścienie bonenceno.
Dibenzalaceton jest w esencji apolarnej i hydrofobowej, ponieważ cała jego struktura jest praktycznie składana z atomów węgla i wodoru. Grupa karbonylowa nadaje mu tylko mały moment dipolowy.
Może ci służyć: aluminiowy fosfuro (AIP): struktura, właściwości, zastosowania, ryzykoStrukturę można utożsamić z arkuszem, ponieważ wszystkie jego atomy węgla mają hybrydyzację SP2; Dlatego spoczywają w tej samej płaszczyźnie.
Fotony świetlne oddziałują z sprzężonym układem π dibenzalacetona; zwłaszcza te z promieniowania UV, wchłaniane w celu podniecenia elektronów. Ta właściwość sprawia, że Dibenzalacetona jest doskonałym chłonnością światła ultrafioletowego.
Mechanizm reakcji Dibenzalacetona
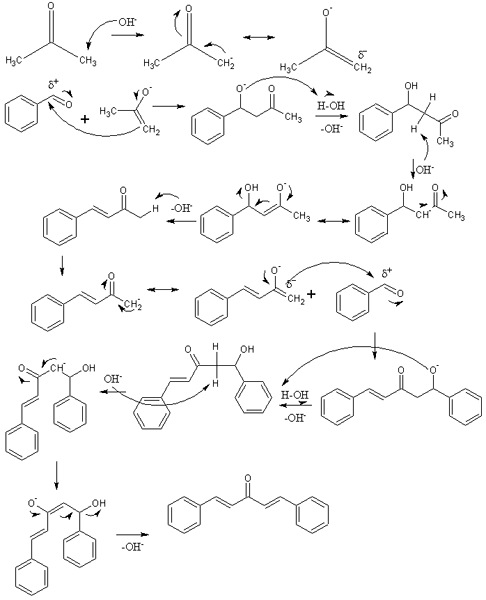 Mechanizm kondensacji aldolicznej w syntezie Dibenzalacetona. Źródło: izmaelt [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Mechanizm kondensacji aldolicznej w syntezie Dibenzalacetona. Źródło: izmaelt [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)] Na lepszym obrazie reprezentowaliśmy mechanizm kondensacji aldolicznej między benzaldehydem a acetonem, aby powstrzymać dibenzalaceton; W szczególności jego izomer trans-trans.
Reakcja zaczyna się od acetonu w podłożu podstawowym. OH- Niewidoczny proton kwasowy z jednej z dwóch grup metylowych, -ch3, Dawanie powstania na zwolnieniu: Cho3C (o) CH2-, który przenosi obciążenie rezonansu ujemnego (pierwszy rząd obrazu).
Ten inolator działa następnie jako środek nukleofilowy: atakuje grupę karbonylową cząsteczki benzaldehydu. Jego włączenie do benzaldehydu wytwarza alkoleń, który, ponieważ jest bardzo podstawowy niszczycielski cząsteczka wody i staje się aldol (drugi rząd). Aldol lub β-hydroksychithon charakteryzuje się posiadaniem grup C = O i OH.
Podstawowa pożywka odwadnia ten aldol, a podwójne wiązanie powstaje w jego strukturze, która generuje benzylideneaceton (trzeci rząd). Potem, och- Również niewidoczny jeden z jego kwaśnych hydrogenów, powtarzając kolejny atak nukleofilowy na drugą cząsteczkę benzaldehydu. Tym razem atak ma miejsce tak szybko (czwarty rząd).
Produkt utworzył niechronioną kolejną cząsteczkę wody i ponownie cierpi odwodnienie w celu wyeliminowania grupy OH i ustanowienia drugiego podwójnego wiązania (piąte i szóste rzędy). Tak więc występuje Dibenzalacetona.
Może ci służyć: Boyle LawSynteza
Odczynniki
Odczynniki do przeprowadzenia syntezy dibenzalacetonu są następujące:
- 95% etanolu.
- Nowo destylowany benzaldehyd z gorzkiego oleju migdałowego.
- Naoh jako podstawowy katalizator w wodzie destylowanej.
Ilości, które należy zastosować, zależą od tego, ile dibenzalacetonu ma on zsyntetyzować. Istnieje jednak nadmiar benzaldehydu, ponieważ jego część jest utleniona do kwasu benzoesowego. Gwarantuje również, że reakcja zajmuje mniej czasu i że niepożądany benzylideneaceton jest wytwarzany w mniejszym stopniu.
Etanol działa jak rozpuszczalnik benzaldehydu, ponieważ w przeciwnym razie nie rozpuściłby się w podstawowym środowisku NaOH.
Procedura
W dużym szkle osadowym etanol miesza się z benzaldehydem. Następnie dodaje się podstawowy medium NaOH podczas ciągłego mieszania magnetycznego. Na tym etapie następuje reakcja Cannizzaro; Oznacza to, że dwie cząsteczki benzaldehydu same w jednym z alkoholu benzylowego i drugiego kwasu benzoesowego, łatwo rozpoznawalne przez jego charakterystyczny słodki zapach.
Wreszcie dodaje się aceton i oczekuje się, że roztwór stanie się pochmurny, a kolor żółty-pomarańczowy. Dibenzalacetona wytrąci się z powodu wody, więc dodaje się znaczną objętość wody w celu promowania jej pełnego opadów.
Dibenzalacetona filtruje w próżnię, a jego żółtawą substancję stałą była lawa kilka razy z wodą destylowaną.
Rekrystalizacja
 Rekrystalizowana próbka Dibenzalacetona musi nosić połysk podobny do kryształów tego obrazu. Źródło: Smokefoot [CC BY-SA (https: // CreativeCommons.Org/licencje/nabrzeże/4.0)]
Rekrystalizowana próbka Dibenzalacetona musi nosić połysk podobny do kryształów tego obrazu. Źródło: Smokefoot [CC BY-SA (https: // CreativeCommons.Org/licencje/nabrzeże/4.0)] Aby oczyszczyć dibenzalaceton, stosuje się 95% etanol lub gorący octan etylu, tak aby powtarzane są kryształy czystości przez za każdym razem, gdy powtarzana jest rekrystalizacja. Zatem początkowe żółtawy kurz zostanie przekształcone w małe żółte kryształy Dibenzalacetona.
Może ci służyć: kwas benzoesowy (C6H5COOH)Aplikacje
Dibenzalacetona to związek, który nie ma zbyt wielu zastosowań. Ze względu na zdolność do wchłaniania światła ultrafioletowego, jest stosowany w preparatach przeciwsłonecznych lub dowolnego innego produktu, który wybiera występowanie promieni UV, powłok lub obrazów.
Z drugiej strony dibenzalaceton jest stosowany w syntezie organometalicznej paladu. Działa jak wiązanie, które koordynuje metaliczne atomy paladowe, PD0, Tworząc kompleks Tris (Dibenzeneacetona) Dipaladio (0).
Ten związek organometaliczny zapewnia atomy PD0 W innej syntezy organicznej, więc zachowuje się jako jednorodny katalizator, ponieważ rozpuszcza się w wielu rozpuszczalnikach organicznych.
Podobnie, Dibenzalacetona jako spoiwa jest łatwa do zastąpienia innych środowisk organicznych, co umożliwia rozwinięcie syntezu organometalicznego paladu.
Ryzyko
Jeśli chodzi o ryzyko, nie ma wielu dostępnych informacji, które doniesienia o możliwym wpływie na zdrowie lub środowisko, które mogą prowadzić do dibenzalacetonu. W swoim czystym stanie jest irytującą substancją stałą do spożycia, oddychania lub bezpośredniego kontaktu z oczami lub skórą.
Jednak najwyraźniej nie jest to wystarczająco irytujące, aby nie mogło być częścią sformułowań filtrów przeciwsłonecznych. Z drugiej strony, będąc tak nierozpuszczalnym w wodzie, jego stężenie w niej jest nieistotne, przedstawiając się jako solidne zanieczyszczenie. W tym sensie nie wiadomo, jak szkodliwe jest dla fauny morskiej lub gleby, które powoduje zmętnienie.
Aż do przeciwności nie zostanie wykazane.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Dibenzylideneacetone. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Dibenzylideneacetone. Baza danych Pubchem., CID = 640180. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Syntezje organiczne. (2020). Dibenzalaceton. Źródło: Orsyn.org
- Dibenzalaceton przez kondensację Aldola. Źródło: Web.Mnstate.Edu
- « Charakterystyka zanieczyszczenia termicznego, konsekwencje, przykłady
- Podstawy jodometrii, reakcje, procedura ogólna, »

