Deuter
- 1737
- 215
- Bertrand Zawadzki
Co to jest deuter?
On deuter Jest to jeden z izotopowych gatunków wodoru, który jest reprezentowany jako d lub 2H. Ponadto podano nazwę ciężkiego wodoru, ponieważ jego masa jest dwukrotnie niż w przypadku protonu. Izotop to gatunek pochodzący z tego samego elementu chemicznego, ale którego masa jest różna od tego.
To rozróżnienie wynika z różnicy w liczbie neutronów. Deuterum jest uważane za stabilny izotop i można go znaleźć w związkach utworzonych przez wodór o naturalnym pochodzeniu, chociaż w dość niewielkim odsetku (mniej niż 0,02 %).
Biorąc pod uwagę jego właściwości, bardzo podobne do właściwości zwykłego wodoru, może zastąpić wodór we wszystkich reakcjach, w których się uczestniczy, stając się równoważnymi substancjami.
Z tego i innych powodów ten izotop ma wiele zastosowań w różnych dziedzinach nauki, stając się jednym z najważniejszych.
Struktura deuteru
Struktura deuteru składa się głównie przez jądro, które ma proton i neutron, o masie atomowej lub masie około 2014 g.
Podobnie izotop ten zawdzięcza swoje odkrycie Haroldowi C. Urey, chemik ze Stanów Zjednoczonych i jego współpracownicy Ferdinand Brickwedde i George Murphy, w 1931 roku.

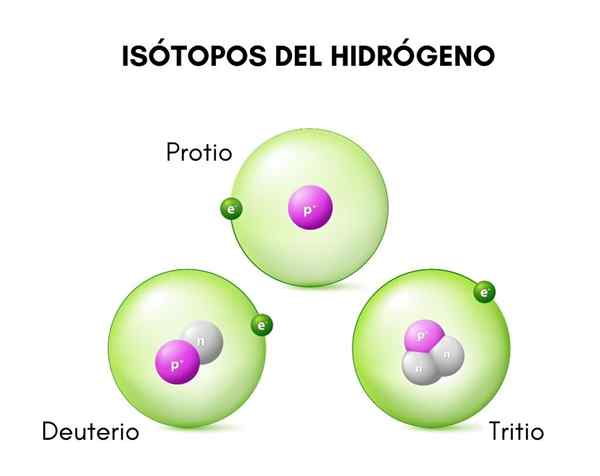
Na górnym obrazie można zobaczyć porównanie struktur izotopów wodoru, który istnieje w formie proto (jego najliczniejszy izotop), deuter i tritium, uporządkowane od lewej do prawej.
Przygotowanie deuteru w jego czystym stanie przeprowadzono z powodzeniem po raz pierwszy w 1933 r., Ale od lat 50. zastosowano substancję w fazie stałej, która wykazała stabilność, zwana deuterkiem litu (LID), do zastąpienia deuteru i tritu w in duża liczba reakcji chemicznych.
Może ci służyć: tlenek chloru (III): Właściwości, struktura, zastosowaniaW tym sensie badano obfitość tego izotopu i zaobserwowano, że jego odsetek w wodzie może się nieznacznie zmieniać, w zależności od źródła, z którego pobierana jest próbka.
Ponadto, poprzez badania spektroskopii, określono istnienie tego izotopu na innych planetach tej galaktyki.
Niektóre dane dotyczące deuteru
Podstawowa różnica między izotopami wodoru (które są jedynymi, które zostały nazwane na różne sposoby) leży w ich strukturze, ponieważ ilość protonów i neutronów gatunku nadają jej właściwości chemiczne.
Z drugiej strony istniejący deuter wewnątrz ciał gwiezdnych jest eliminowany z szybszą prędkością niż powstaje.
Ponadto uważa się, że inne zjawiska natury tworzą tylko bardzo niewielką ilość, więc jego produkcja nadal generuje zainteresowanie.
Podobnie seria badań ujawniła, że zdecydowana większość atomów, które powstały w tym gatunku, pochodzi z Wielkiego Wybuchu; To jest powód, dla którego ostrzega jego obecność na dużych planach, takich jak Jowisz.
Ponieważ najczęstszym sposobem osiągnięcia tego gatunku w naturze jest to, gdy jest on łączony z wodorem w postaci proto, zainteresowanie społeczności naukowej wciąż budzi relacje ustanowione między odsetkiem obu gatunków w różnych dziedzinach nauk, takich jak jako astronomia lub pogoda.
Może ci służyć: renio: odkrycie, właściwości, struktura, zastosowaniaWłaściwości deuteru
- Jest to izotop pozbawiony cech radioaktywnych; to znaczy jest dość stabilny z natury.
- Można go zastosować do wymiany atomu wodoru w reakcjach chemicznych.
- Gatunek ten objawia zachowanie inne niż zwykły wodór w reakcjach biochemicznych.
- Gdy dwa atomy wodoru zostaną zastąpione w wodzie, uzyskano D2Lub nabywanie nazwy ciężkiej wody.
- Wodór obecny w oceanie, który ma postać deuteru, istnieje w proporcji 0,016 % w odniesieniu do proto.
- W gwiazdach ten izotop ten ma tendencję do szybkiego łączenia się, aby wywołać hel.
- D2Lub stanowi toksyczne gatunki, chociaż jego właściwości chemiczne są bardzo podobne do właściwości H2
- Gdy atomy deuterowe są poddawane procesie fuzji jądrowej w wysokich temperaturach, otrzymuje się oderwanie dużych ilości energii.
- Właściwości fizyczne, takie jak temperatura wrzenia, gęstość, ciepło odparowywania, między innymi potrójne punkty mają poważne wielkości cząsteczek deuterowych (D2) to w wodorze (h2).
- Najczęstszym sposobem, w jaki go stwierdza, jest powiązany z atomem wodoru, powodując deuterek wodoru (HD).
Używa/aplikacje
Ze względu na swoje właściwości deuter jest stosowany w szerokiej gamie zastosowań, w których zaangażowany jest wodór. Niektóre z tych zastosowań opisano poniżej:
- W dziedzinie biochemii jest stosowany w znakowaniu izotopowym, które polega na „oznaczeniu” próbki z izotopem wybranym do śledzenia jej przejścia przez dany system.
Może ci służyć: silny kwas- W reaktorach jądrowych, które wykonują reakcje fuzyjne, służy do zmniejszenia prędkości, z jaką neutrony poruszają się bez wysokiego wchłaniania.
- W obszarze jądrowego rezonansu magnetycznego (NMR) rozpuszczalniki oparte na deuterium są wykorzystywane do uzyskania próbek tego rodzaju spektroskopii bez obecności zakłóceń, które są wytwarzane przez stosowanie rozpuszczalników uwodornionych.
- W dziedzinie biologii makrocząsteczki są badane za pomocą technik dyspersyjnych neutronów, w których próbki dostarczane z deuterum są używane do znacznego zmniejszenia hałasu w tych właściwościach kontrastowych.
- W obszarze farmakologii wymiana wodoru jest używana przez deuter z kinetycznym efektem izotopowym, który jest wytwarzany i pozwala tym lekom na dłuższą półfinię.