Halogeneowane pochodne

- 2206
- 480
- Pani Waleria Marek
Wyjaśniamy, jakie są hukleanne pochodne, ich właściwości, zastosowania/zastosowania i podajemy kilka przykładów
Jakie są ukochane pochodne?
Halogeneowane pochodne Wszystkie są związkami, które mają atom halogenowy; to znaczy każdy z elementów grupy 17 (f, cl, br, i). Elementy te różnią się od reszty, ponieważ są bardziej elektroonywacyjne, tworząc różnorodność halogenków nieorganicznych i organicznych.
Niższy obraz halogenów pokazano na dolnym obrazie. Od góry do dołu: fluor (f2), Chlor (CL2), Bromo (br2) i jod (i2). Każdy z nich ma zdolność reakcji z ogromną większością elementów, w tym między kongenerami tej samej grupy (interhalogeny).

Zatem halogeniowane pochodne mają wzór MX, jeśli jest to metalowy halluro, rx, jeśli jest alkil i arx, jeśli jest aromatyczny. Dwa ostatnie znajdują się w kategorii ekologicznej Halluros. Stabilność tych związków wymaga „korzyści” energii przed pierwotną cząsteczką sody.
Zgodnie z zasadą fluorek tworzy fluorogenowany bardziej stabilny niż jod. Przyczyną są różnice między ich radiom atomowym (fioletowe kule są bardziej nieporęczne niż żółte).
Zwiększając promień atomowy, nakładanie się orbitali między halogenem a drugim atomem jest biedniejsze, a zatem łącze jest słabsze.
Nomenklatura
Sposób prawidłowego nazwania tych związków zależy od tego, czy są one nieorganiczne czy organiczne.
Nieorganiczny
Halogenki metaliczne składają się z wiązania, jonowego lub kowalencyjnego, między halogenem X a metalem M (grup 1 i 2, metali przejściowych, metali ciężkich itp.).
W tych związkach wszystkie halogeny mają stan utleniania -1. Ponieważ? Ponieważ jego konfiguracje Valencia to NS2NP5.
Dlatego muszą wygrać tylko jeden elektron, aby ukończyć okT w Walencji, podczas gdy metale utleniają się, dając im elektrony, które mają.
Może Ci służyć: Precision Bilans: Charakterystyka, funkcje, części, zastosowaniaZatem fluor pozostaje jak F-, fluorek; Cl-, chlorek; Br-, bromek; I ja-, ja ostatni. MF zostałby nazwany: fluorek (nazwa metalowej) (n), będąc n Valencia del Metal tylko wtedy, gdy ma więcej niż jeden. W przypadku grup grup 1 i 2 nie trzeba nazwać Walencji.
Przykłady
- NAF: fluor sodu.
- Cacl2: chlorek wapnia.
- AGBR: Srebrny bromek.
- Zni2: Cynk Yoduro.
- CUCL: Chlorek miedzi (i).
- Cucl2: chlorek miedzi (ii).
- Ticl4: Chlorek tytanu (IV) lub tetrachlorek tytany.
Jednak pierwiastki wodoru i niemetalne - nawet te same halogeny - mogą również tworzyć haluros. W takich przypadkach walencja z metalu no nie jest mianowana na końcu:
- PCL5: Pentachlorek fosforu.
- Bf3: Boro Trifluoruro.
- Ali3: Aluminium triyoduro.
- HBR: bromek wodoru.
- Jeśli7: heptofluorek jodu.
Organiczny
Niezależnie od tego, czy RX, czy ARX, halogen jest kowalencyjnie związany z atomem węgla. W takich przypadkach halogeny są wymienione przez ich nazwy, a reszta nomenklatury zależy od struktury molekularnej R lub AR.
Dla najprostszej cząsteczki organicznej, metan (cho4), Następujące pochodne uzyskuje się przez zastąpienie H CL:
- Ch3CL: Chlorometan.
- Ch2Cl2: Dichlorometan.
- Chcl3: tricylorometan (chloroform).
- CCl4: Tetrachlorometan (chlorek węglowy (IV) lub tetrachlor węglowy).
Tutaj R składa się z pojedynczego atomu węgla. Następnie, w przypadku innych łańcuchów alifatycznych (liniowych lub gałęzi) liczba węgli, z których jest powiązana z halogenem:
Ch3Ch2Ch2F: 1-fluorpropano.
Poprzedni przykład był pierwotnym halogenkiem alquilicznym. W przypadku rozgałęzionego łańcucha, najdłuższy zawierający halogen jest wybierany i zaczyna się liczyć, pozostawiając to jako możliwą liczbę:
Może ci służyć: jakie są fizyczne właściwości materii?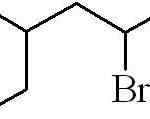
3-metylo-5-bromoheksan
W ten sam sposób, w jaki występuje dla innych podstawników. Ponadto dla halogenków aromatycznych wyznacza się halogen, a następnie reszta struktury:

Najwyższy obraz pokazuje związek zwany bromobenzenem, podkreślając atom bromowy w brązowym.
Właściwości fluorowcowanych pochodnych
Halogenki nieorganiczne
Halogenki nieorganiczne są jonowe lub molekularne, chociaż te pierwsze są bardziej obfite. W zależności od interakcji i radia jonowych MX, będzie to rozpuszczalne w wodzie lub innych mniej polarnych rozpuszczalnikach.
Halogendy niemetaliczne (takie jak boro) są zwykle kwasami Lewisa, co oznacza, że akceptują elektrony tworzenia kompleksów. Z drugiej strony halogendy (lub halogenomory) wodoru rozpuszczone w wodzie wytwarzają tak zwane hydracidy.
Jego temperatury topnienia, gotowanie lub sublimacja spadają na interakcje elektrostatyczne lub kowalencyjne między metalem lub nie -metalowym z halogenem.
Podobnie radia jonowe odgrywają ważną rolę w tych właściwościach. Na przykład, jeśli m+ i x- Mają podobne rozmiary, ich kryształy będą bardziej stabilne.
Halogenki organiczne
Są polarne. Ponieważ? Ponieważ różnica w elektroonetronegatyczności między C i halogenu tworzy trwałe moment polarny w cząsteczce. Również zmniejsza się to wraz ze spadkiem grupy 17 z linku C-F do C-I.
Bez uwzględnienia struktury molekularnej R lub AR, rosnące liczby halogenów bezpośrednio wpływają na temperaturę wrzenia, ponieważ zwiększają masę molową i interakcje międzycząsteczkowe (RC-X-X-CR). Większość z nich jest niemożliwa z wodą, ale mogą rozpuszczać się w rozpuszczalnikach organicznych.
Zastosowania huknogenowanych pochodnych
Zastosowanie huksetowanych pochodnych może zarezerwować własny tekst. Molekularne „towarzysze” halogenów są kluczowym czynnikiem, biorąc pod uwagę, że ich właściwości i reaktywność definiują zastosowania pochodnej.
Może ci służyć: siarczan potasu (K2SO4): struktura, właściwości, zastosowania, syntezaZatem wśród wielkiej różnorodności możliwych zastosowań wyróżniają się następujące:
- Halutyki molekularne są używane do tworzenia żarówek halogenowych, w których kontaktujesz się z żarliwym włóknem wolframowym. Celem tej mieszaniny jest reakcja halogenu X z odparowanym wolframem. W ten sposób unika się jego osadzania na powierzchni żarówki, gwarantując więcej czasu życia.
- Sole fluorowe są stosowane w fluoralizacji wód dentystycznych i pastów.
- Hipochlority sodu i wapnia to dwa czynne czynniki w komercyjnych roztworach bielenia (chlor).
- Chociaż pogarszają się warstwa ozonowa, chlorofluorokarbony (CFC) są stosowane w aerozolu i systemach chłodzenia.
- Chlorek winylu (Cho2= CHCl) to monomer chlorku polimeru winylu (PVC). Z drugiej strony teflon, używany jako materiał bez stałego, składa się z łańcuchów polimerowych tetrafluoretylen (F2C = CF2).
- Są one stosowane w chemii analitycznej i syntezy organicznej do różnych celów; Wśród nich synteza leków.
Dodatkowe przykłady

Najwyższy obraz ilustruje hormon tarczycy, odpowiedzialny za produkcję ciepła, a także wzrost ogólnego metabolizmu w ciele. Ten związek jest przykładem flueniowanej pochodnej obecnej w ludzkim ciele.
Wśród innych związków fluogenowanych wspomniano:
- DiClorodifenilriclorootan (DDT), skuteczny owadobójca, ale z poważnymi wpływami na środowisko.
- Chlorek cyny (SNNCL2), używany jako środek redukujący.
- Chloroetan lub 1-chloroetan (ch3Ch2CL), miejscowe znieczulenie, które szybko się chłodzi skórę.
- Dichloroetylen (clch = cclh) i tetrachloroetylen (cl2C = CCl2), stosowany jako rozpuszczalniki w branży czyszczenia na sucho.
- « Krzemowa struktura chemiczna, właściwości i zastosowania
- 80 zwrotów dla pierwszej miłości, która nigdy nie zapomina »

