Krzywa ogrzewania Czym jest, jak to jest, przykłady

- 2690
- 308
- Gabriela Łuczak
A Krzywa ogrzewania Jest to graficzna reprezentacja tego, jak temperatura próbki zmienia się w zależności od czasu, utrzymując stałe ciśnienie i równomierne dodanie ciepła, to znaczy ze stałą prędkością.
Aby zbudować taki wykres, pobierane są pary wartości temperatury i czasu, które następnie wykresują temperaturę na osi pionowej (uporządkowanej) i czasu na osi poziomej (ASSCHISSA).
 Rysunek 1. Krzywa grzewcza substancji uzyskuje się przez dodanie ciepła i pomiar temperatury za każdym razem. Źródło: Pixabay.
Rysunek 1. Krzywa grzewcza substancji uzyskuje się przez dodanie ciepła i pomiar temperatury za każdym razem. Źródło: Pixabay. Następnie najbardziej odpowiednia krzywa do tych punktów eksperymentalnych jest dostosowywana i wreszcie wykres temperatury t jest uzyskiwana jako funkcja czasu t: t (t).
[TOC]
Jaka jest krzywa grzewcza?
Gdy się rozgrzewa, substancja przechodzi kolejno zróżnicowane stany: bycie solidnym może parować, prawie zawsze przechodząc przez stan płynny. Procesy te nazywane są zmianami stanu, w których próbka zwiększa swoją energię wewnętrzną podczas dodawania ciepła, na co wskazuje teoria kinetyczna molekularna.
Dodając ciepło do próbki, istnieją dwie możliwości:
- Substancja zwiększa jej temperaturę, biorąc pod uwagę fakt, że jej cząsteczki mieszają się z większą intensywnością.
- Materiał przechodzi zmianę fazową, w której temperatura pozostaje stała. Dodaj ciepło powoduje osłabienie w pewnym stopniu siły, które utrzymują cząsteczki spójne, więc na przykład łatwo jest przejść od lodu do ciekłej wody.
Ryc. 2 pokazuje cztery stany materii: stałe, ciekłe, gazowe i osocze oraz nazwy procesów, które umożliwiają przejście między sobą. Strzałki wskazują znaczenie procesu.
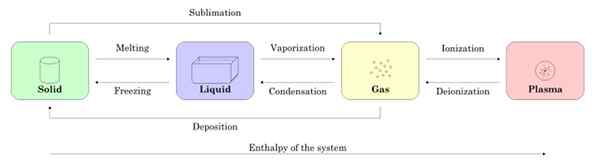 Rysunek 2. Stany podmiotu i procesy niezbędne do przejścia między jednym a drugim. Źródło: Wikimedia Commons.
Rysunek 2. Stany podmiotu i procesy niezbędne do przejścia między jednym a drugim. Źródło: Wikimedia Commons. -Zmiany stanu w substancji
Zaczynając od próbki w stanie stałym, gdy topnienie przechodzi do stanu ciekłego, ponieważ jest on odparowywanie, staje się gaz.
Może ci służyć: magnetyczne właściwości materiałówCiała może stać się gazem bezpośrednio poprzez proces znany jako sublimacja. Istnieją substancje, które łatwo sublimowe w temperaturze pokojowej. Najbardziej znany jest co2 lub suchy lód, a także naftalen i jod.
Podczas gdy próbka przecina zmianę stanu, temperatura pozostaje stała, dopóki nie osiągnie nowego stanu. Oznacza to, że jeśli na przykład istnieje część ciekłej wody, która osiągnęła swoją temperaturę wrzenia, jej temperatura pozostaje stała, dopóki cała woda stanie się parą.
Z tego powodu oczekuje się, że krzywa grzewcza składa się z kombinacji rosnących odcinków i sekcji poziomych, w których te ostatnie odpowiadają zmianom fazowym. Rycina 3 pokazuje jedną z tych krzywych dla danej substancji.
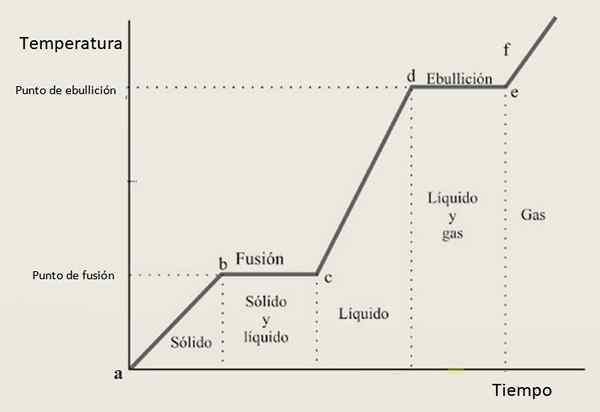 Rysunek 3. Krzywa grzewcza danej substancji, z typową konfiguracją opartą na krokach i zboczach.
Rysunek 3. Krzywa grzewcza danej substancji, z typową konfiguracją opartą na krokach i zboczach. Interpretacja krzywej grzewczej
W odstępach wzrostu Ab, płyta CD I Ef Substancja znajduje się odpowiednio jako stałe, ciekłe i gazowe. W tych regionach energia kinetyczna wzrasta, a wraz z nią temperatura.
Tymczasem w pne jego stan od stałego do cieczy zmienia się, dlatego dwie fazy współistnieją. Tak jest w przypadku sekcji z, w którym próbka przechodzi z płynu gazowego. Tutaj zmienia energię potencjalną, a temperatura pozostaje stała.
Procedura odwrotna jest również możliwa, to znaczy próbka można schłodzić, aby przyjęła sukcesywnie inne stany. W takim przypadku mówi się o krzywa chłodzenia.
Krzywe grzewcze mają ten sam ogólny aspekt dla wszystkich substancji, choć oczywiście nie te same wartości liczbowe. Niektóre substancje wymagają więcej czasu niż inne, aby zmienić stan, a stop i odparuj w różnych temperaturach.
Punkty te są znane odpowiednio jako temperatura topnienia i temperatura wrzenia i są cechami każdej substancji.
Może ci służyć: płaskie lustra: równanie, zachowanie, grafikaWłaśnie dlatego krzywe grzewcze są bardzo przydatne, ponieważ wskazują wartość liczbową tych temperatur dla milionów substancji, które istnieją jako stałe i ciecze w zakresie temperatur uważanych za normalne i przy ciśnieniu atmosferycznym.
Jak powstaje krzywa grzewcza?
Zasadniczo jest to bardzo proste: wystarczy umieścić próbkę substancji w pojemniku dostarczonym z mieszadłem, wprowadzić termometr i równomiernie ciepło.
Jednocześnie na początku procedury aktywuje się stopwatch i odnotowano odpowiednie pary temperatury.
Źródłem ciepła może być zapalniczka gazowa, z dobrą prędkością ogrzewania lub rezystancją elektryczną, która gdy ciepło emituje ciepło, które może połączyć się z zmiennym źródłem, aby uzyskać różne moce.
Dla większej precyzji istnieją dwie techniki szeroko stosowane w laboratorium chemii:
- Różnicowa analiza termiczna.
- Różnicowa kalorymetria zamiatania.
Porównują różnicę temperatur między badaną próbką a inną próbką odniesienia o wysokiej temperaturze topnienia, prawie zawsze tlenek glinu. Te metody mają łatwe znalezienie punktów fuzji i wrzenia.
Przykłady (woda, żelazo ...)
Rozważ krzywe grzewcze dla wody i żelaza pokazane na rysunku. Skala czasu nie jest pokazana, jednak jest natychmiastowa.
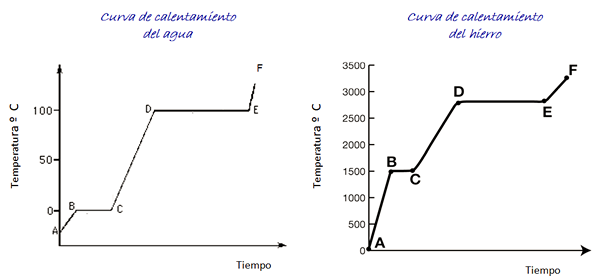 Rysunek 4. Krzywe ogrzewania wody i żelaza.
Rysunek 4. Krzywe ogrzewania wody i żelaza. Woda jest substancją uniwersalną, a zakres temperatur niezbędny do zobaczenia jej zmian stanowych jest łatwy do osiągnięcia w laboratorium. W przypadku żelaza wymagane są znacznie wyższe temperatury, ale jak wskazano powyżej, kształt wykresu nie zmienia się.
Może ci służyć: Twierdzenie Steiner: Wyjaśnienie, aplikacje, ćwiczeniaTopniejący lód
Podczas podgrzewania próbki lodowej, zgodnie z wykresem, jesteśmy w punkcie A, w temperaturze poniżej 0º C. Zaobserwowano, że temperatura rośnie ze stałą szybkością, aż osiągnie 0º C.
Cząsteczki wody wewnątrz lodu wibrują większą szerokość. Po osiągnięciu temperatury topnienia (punkt B) cząsteczki mogą już poruszać się przed innym.
Energia, która przyjeżdża, jest inwestowana w zmniejszenie siły przyciągania między cząsteczkami, więc temperatura między B i C pozostaje stała dla wszystkich lodu, stopiła się.
Zamień wodę w parę
Gdy woda jest całkowicie w stanie ciekłym, wibracja cząsteczek ponownie wzrasta, a temperatura gwałtownie wzrasta między C i D do temperatury wrzenia o 100º C. Między D i E temperatura pozostaje w tej wartości, podczas gdy energia, która przybywa, jest odpowiedzialna za całą wodę w pojemniku do odparowania.
Jeśli cała para wodna jest zawarta w pojemniku, można go kontynuować z punktu E do punktu F, którego granice nie jest pokazane na grafice.
Żelazna próbka może przekroczyć te same zmiany. Jednak biorąc pod uwagę charakter materiału, zakresy temperatury są bardzo różne.
Bibliografia
- Atkins, str. Zasady chemii: ścieżki odkrycia. Pan -american Medical Redaktorial. 219-221.
- Chung, s. Krzywe grzewcze. Odzyskane z: chem.Librettexts.org.
- Krzywe grzewcze. Ciepło fuzji i parowania. Odzyskane z: Wikipremed.com.
- Hewitt, Paul. 2012. Konceptualna nauka fizyczna. 5. Wyd. osoba. 174-180.
- University of Valladolid. Stopień chemii, odzyskany z: zakwaterowanie.winogrono.Jest.
- « Etapy cyklu Carnot, aplikacje, przykłady, ćwiczenia
- Bromokresolowe zielone cechy, przygotowanie, wykorzystanie »

