Podstawy, typy, aplikacje

- 3575
- 459
- Pani Waleria Marek
Coulombymetria Jest to technika analizy elektrochemicznej, która polega na przeprowadzaniu wyczerpującej elektrolizy, aby analit można było określić ilościowo; Oznacza to, że ustalenie stężenia analitu w problemach problemów poprzez jego całkowite utlenianie lub zmniejszenie. Jest to, w przeciwieństwie do potencjometrii, dynamiczna technika, ponieważ prąd może swobodnie przepływać przez komórki elektrochemiczne.
Jak sugeruje jego nazwa, ładunek elektryczny Q, w jednostkach kulombowych, C, jest mierzony i skorelowany ze stężeniem utlenionego lub zmniejszonego analitu na peryferyjnych elektrodach. Dlatego stany utleniania analitu zmieniają się w procesie przenoszenie i wchłanianie elektronów, które umożliwiają obliczenie stechiometryczne pożądanego stężenia.
 Podstawowe montaż do elektrolizy, w której powstaje kilka kolorowych gatunków z powodu pH i kompleksowania leśników. Źródło: Steve Jurvetson z Menlo Park, USA, CC.0, Via Wikimedia Commons
Podstawowe montaż do elektrolizy, w której powstaje kilka kolorowych gatunków z powodu pH i kompleksowania leśników. Źródło: Steve Jurvetson z Menlo Park, USA, CC.0, Via Wikimedia Commons W kuliszetrii bateria lub potencjostat służy do kontrolowania prądu lub potencjału zastosowanego do ogniw. Komórki te, w przeciwieństwie do potencjometrycznych, składają się z układu trzech elektrod i są wyposażone w woltometr i amperomierz.
Coulombymetria stanowi zaletę, że możliwość wykonywania stopni bez przygotowywania lub standaryzacji wzorów. Umożliwia także ilościowe bardzo małe i ograniczone ilości analitu, takie jak kationy metali, związki nieorganiczne i związki organiczne. Na przykład, jest kulometr zaprojektowany wyłącznie do pomiaru CO2 Rozpuszczone w próbkach z oceanu.
Ta technika oferuje inną trasę analityczną niż objętościowe i potencjometryczne, tak wiele analiz, w zależności od elektrochemicznego charakteru analitu, może rozwijać się coulommetrycznie.
Teoretyczne podstawy kuliszetrii
Prawo Faraday
Coulombymetria opiera się na prawie Faradaya, które ustanawia związek między ładunkiem elektrochemicznym komórki elektrochemicznej a ilością analitu, który utlenia się lub zmniejsza. Znajomość tego obciążenia Q, a także obciążenie elektronu (1.6 · 10-19 C), możesz obliczyć liczbę elektronów zaangażowanych w reakcję, NI-:
NI- = Q/e
Z drugiej strony wiadomo, że jeden mol elektronów (6.02 · 1023) Porta ładunek elektryczny równy 96485 C, liczba znana jako stała Faraday:
F = inDO
= 96485.3365 C/mol
Wygodne wyrażanie ilości elektronów w zależności od moli. Dzięki temu można zastosować współczynniki stechiometryczne reakcji elektrochemicznej, utlenianie lub redukcja, biorąc pod uwagę, ile moli elektronów wygrywa lub przegrywa gatunek.
Może ci służyć: fosforan sodu: struktura, właściwości, synteza, zastosowaniaPodstawowe obliczenia
Rozważmy na przykład następujące równanie chemiczne:
OX + 2E- → Sieć
Mierząc, że gdy cały gatunek wołu został zredukowany do sieci, możemy obliczyć mole wołu przy użyciu współczynników konwersji:
xq · (mol e- /96485.3365 c) · (mol wox/ 2mol e-) = mol wół
To znaczy, jak znamy ładunek elektryczny mol elektronów, będziemy mieli liczbę elektronów odpowiada obciążeniu XQ. Ale z kolei każde 2 mole tych elektronów są używane do utleniania 1 mol wół.
To rozumowanie powoduje bezpośredni formułę, nawet jeśli nie jest zalecane do jej zapamiętywania, ale możliwość wywnioskowania go tak, jak to się stało:
N = Q/(fNI-)
Gdzie NI- Jest to liczba moli elektronów w równaniu chemicznym.
Pod warunkiem, że można go obliczyć Q, niezależnie od rodzaju kuliszetrii, mole z analitu OX lub sieci można określić; Tak długo, jak wydajność prądu wynosi 100%. To ostatnie oznacza, że całe obciążenie, które musi być iloczynem tylko jednej transformacji, bez zmniejszenia lub utleniania innych gatunków.
Eksperymentalne podstawy kuliszetrii
Komórki
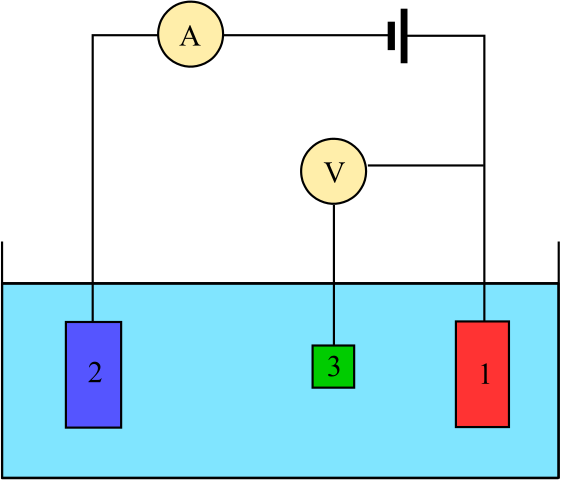 Schemat komórki elektrochemicznej złożonej z trzech elektrod: odniesienia (3), asystenta (2) i pracy (1). Źródło: Adam Rędzikowski, CC BY-SA 3.0, Via Wikimedia Commons
Schemat komórki elektrochemicznej złożonej z trzech elektrod: odniesienia (3), asystenta (2) i pracy (1). Źródło: Adam Rędzikowski, CC BY-SA 3.0, Via Wikimedia Commons W górę mamy schemat ogniwa z trzema elektrodami, który jest powszechnie stosowany w analizach coulombimetrycznych. Reakcja redoks zachodzi wśród elektrod roboczych (1) i pomocniczych (2). Wśród nich dwa są podłączone akumulator, aby zastosować potencjał do ogniwa i amperomierz (a) do pomiaru prądów elektrycznych.
Jednak elektroda odniesienia (3) jest potrzebna do monitorowania potencjału elektrody roboczej, a tym samym znać zmianę potencjału elektrody pomocniczej. W ten sposób można określić potencjał całej komórki ikomórka, niezbędne do oszacowania końca reakcji redoks w jednym z rodzajów kuliszetrii.
Należy zauważyć, że między elektrodą roboczą a elektrodą odniesienia prawie nie przepływa prądu z powodu wysokiej impedancji (V), dzięki której istnieje odczyt potencjału elektrody roboczej. Pomiędzy tymi dwiema elektrodami mamy system podobny do analizy potencjometrycznej: jest statyczny i nie dynamiczny.
Może ci służyć: chemia nuklearna: historia, dziedzina studiów, obszary, zastosowaniaPotencjał
Coulombymetria jest, że tak powiem, elektroliza przeprowadzona do celów analitycznych i ilościowych. Dlatego mówi się o stosowaniu potencjałów zewnętrznych, dostarczanych przez baterię, do wykonywania niespontanicznych reakcji elektrochemicznych; to znaczy te, które mają negatywne potencjały.
Rozważmy na przykład następujące reakcje, które towarzyszą ich odpowiednie potencjalne standardy:
Cu2+ + 2e- ⇌ Cu (y) eºsiatka = +0.337 v
H2Lub ⇌ 1/2O2(g) + 2h+ + 2e- Eºsiatka = +1.230 v
Będąc równaniem globalnej reakcji równych:
Cu2+ + H2Lub ⇌ cu (s) + 1/2o2(g) + 2h+ Eºsiatka = -0.893 v
Bateria musi zastosować potencjał 0.893 V, aby elektroda miedziana i tworzenie jonów wodoru jest możliwe. Ten potencjał to Ekomórka. Jednak w praktyce należy zastosować potencjał większy niż obliczony, ponieważ istnieją potencjały przeciwne ewolucji reakcji:
Ikomórka = Ekatoda - Ianoda - OP - IR - CP
Gdzie,
OP: Nadpotencjał (bariera kinetyczna)
IR: Ohmic (wewnętrzny potencjał komórek)
CP: polaryzacja stężeń (produkt spadku Cu2+)
Rodzaje Coulombymetry
Istnieją trzy rodzaje kuliszetrii: amperostatyczny, potencjostatyczny i elektrogravimetryczny.
Amperostatyczny lub galwanostatyczny
W tego typu kuliszetrii prąd, który przepływa przez komórkę, jest stały za pomocą amperostatu. Dlatego posiadanie bieżącego Siema Dzięki czytaniu amperomierza, a także znajomość czasu T Po zakończeniu elektrolizy możemy obliczyć obciążenie związane z transformacją analitu:
Q = Przedmiot
Konsekwencją utrzymania stałej prądu jest to, że elektroduje potencjalną zmianę, pozytywnie lub negatywnie. Ta nagłe zmienność wskazuje, że analit całkowicie zareagował, czyli wtedy, gdy elektroliza zatrzymuje się i jest mierzona T. To jest podstawa stopni kulometrycznych.
Jeśli potencjał będzie kontynuowany lub przesyłający, inne niepożądane gatunki elektroaktywne skończą się reagą. Dlatego potencjały związane z transformacją zainteresowania powinny być doskonale znane.
Potencjostatyczny
Jeden sposób zapobiegania innym gatunkom. To tutaj wchodzi potencjotyzotyczna kuliszetria. W przeciwieństwie do kulmetrii amperostatycznej, teraz bieżący zmienia się w miarę upływu czasu.
Może ci służyć: tolueen: struktura, właściwości, użycia, uzyskiwanieZ powodu tej konfiguracji technicznej nie możemy tego obliczyć bezpośrednio na podstawie wartości Siema I T; Prąd maleje z czasem. Wynika to z faktu, że gdy analit reaguje, będzie coraz mniej cząsteczek lub atomów, które przekazują lub akceptują elektrony. Dlatego, co jest równe obszarowi integralnym pod krzywą graficzną Siema vs T.
Elektrograficzne
Coulombymetria elektrograficzna, po prostu znana jako elektrograwymetria, jest elektrolizą, w której nie jest konieczne mierzenie obciążeń lub prądów elektrycznych. Zamiast tego masy elektrod są mierzone przed i po elektrolizy.
Ta technika ma zastosowanie tylko wtedy, gdy zmniejszone gatunki są kationami metalowymi, które są elektrodepami na elektrodach, co czyni je cięższymi.
Aplikacje
Potencjostetyczne
Analizy potencjostetyczne pozwalają na selektywne zmniejszenie lub utlenianie jednego gatunku na środku mieszanki. Na przykład są one używane do określenia stężenia następujących jonów nieorganicznych w ilościach śladów lub w złożonych matrycach:
-Cu2+
-As3+
-płyta CD2+
-Współ2+
-Wiara2+ i wiara3+
-Pb2+
-X (f-, Cl-, Br- i ja-)
-Żaden2+
-Pu3+
-Ag+
-Sn2+
-Zn2+
-LUB6+
Również te analizy można wykorzystać do określenia składu stopu. Po rozpuszczeniu stopu kwasu potencjały komórek są stosowane w sposób rozłożony i kontrolowany, określając w ten sposób zmniejszoną ilość dla każdego kationu metalu, który go integruje.
Stopnie kulometryczne
W stopniach coulometrycznych stosuje się środki pośredniczące, które upewniają się, że całkowicie zneutralizacja lub reagowanie z pozostałym analitem. Celem tego jest zapobieganie potencjalnym zmianom, do stałego prądu, wyprowadzenie reakcji zabezpieczenia. Zatem możliwe jest, na przykład, kwas askorbinowy za pomocą jodu jako mediatora.
Niektóre metalowe kationy, takie jak AG+, Ec3+, Wiara3+, Mn2+, Ty3+, Cr2+, Można je również określić przez te stopnie.
Z drugiej strony reakcje kwasowo-zasadowe mogą nadal stosować tę technikę, ponieważ duże potencjały powodują, że woda jest jonowa3ALBO+ lub och-, które służą od agentów tytułowych, którzy są generowani na miejscu; Oznacza to, że zneutralizują obecne kwasy lub podstawy.
Co2 oceanu, reakcji wytrącania i tworzenia kompleksów z EDTA są również możliwe do ich analizy poprzez zastosowanie stopni Coulometrycznych, w których dodawane są wskaźniki redoks w celu podkreślenia końcowego punktu elektrolizy.
Bibliografia
- Dzień, r., & Underwood, a. (1986). Ilościowa chemia analityczna (Ed.). Pearson Prentice Hall.
- Skoog d.DO., West d.M. (1986). Analiza instrumentalna. (Drugi wyd.). Inter -American., Meksyk.
- Dr. Doug Stewart. (2020). Definicja kulometrii. Odzyskane z: Chemicool.com
- Wikipedia. (2020). Coulometria. Źródło: w:.Wikipedia.org
- Harvey David. (5 czerwca 2019). Metody kulometryczne. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- « Ramy metodologiczne, jak to pisać, struktura, przykłady
- Współczesne pochodzenie filozofii, cechy, prądy, autorzy »

