Przykłady konfiguracji elektronicznej jądra, przykłady
- 3527
- 132
- Marianna Czarnecki
Konfiguracja elektroniczna jądra lub kompaktowe to takie, których kwantowe zapisy o liczbie elektronów i ich poziomów energii są skrócone przez symbole szlachetnych gazów w nawiasach kwadratowych. Jest to bardzo przydatne podczas pisania konfiguracji elektronicznych dla określonego elementu, ponieważ jest prosty i szybki.
Słowo „jądro” zwykle odnosi się do elektronicznych wewnętrznych warstw atomu; To znaczy te, w których ich elektrony nie pochodzą z Walencji i dlatego nie uczestniczą w wiązaniu chemicznym, chociaż określają właściwości elementu. Metaforycznie, jądro byłoby wnętrzem cebuli, z warstwami złożonymi z serii rosnących orbitali energii.
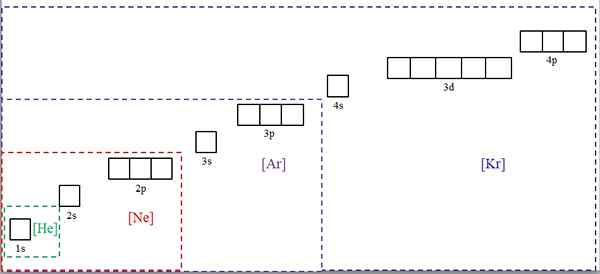
 Konfiguracje elektroniczne skrócone z symbolami gazów szlachetnych. Źródło: Gabriel Bolívar.
Konfiguracje elektroniczne skrócone z symbolami gazów szlachetnych. Źródło: Gabriel Bolívar. Najwyższy obraz pokazuje symbole chemiczne dla czterech szlachetnych gazów w nawiasach kwadratowych i z różnymi kolorami: [HE] (zielony), [ne] (czerwony), [ar] (fioletowy) i [Kr] (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski) (niebieski).
Każda z jego kropkowanych ramek zawiera pola reprezentujące orbitale. Im większa, tym większa liczba elektronów zawierających; Co z kolei będzie oznaczać, że elektroniczne konfiguracje większej liczby elementów można uprościć za pomocą tych symboli. To oszczędza czas i energię, pisząc wszystkie notacje.
[TOC]
Zamówienie budowy
Przed użyciem konfiguracji elektronicznych jądra wygodne jest przejrzenie prawidłowej kolejności, aby zbudować lub napisać te konfiguracje. Jest to regulowane zgodnie z regułą przekątnej lub diagramu Moellera (zwanego w niektórych częściach deszczu). Posiadając ten schemat, notacje kwantowe pozostają następujące:
1S 2S 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Może ci służyć: sole podstawowe: formuła, właściwości, nomenklatura, przykładyTen rząd notacji kwantowych wygląda na wyczerpane; I byłoby jeszcze bardziej, gdybyś musiał to napisać przez cały czas, aby reprezentować konfigurację elektroniczną dowolnego elementu, który został znaleziony w okresie od 5. Zauważ, że rząd jest pusty z elektronów; Nie ma liczb na prawach wyższych (1s22s22 p6…).
Należy pamiętać, że orbitale S może „hostować” dwa elektrony (NS2). Orbitale P W sumie są trzy (spójrz na trzy pudełka powyżej), więc mogą hostować sześć elektronów (NP6). I wreszcie orbitale D Jest ich pięć i F siedem, mając łącznie dziesięć10) i czternaście (NF14) Elektrony odpowiednio.
Skrót konfiguracji elektronicznej
To powiedziawszy, przedni rząd notacji kwantowych jest wypełniony elektronami:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Ile elektronów jest w sumie? 118. I który element odpowiada tak ogromnej ilości elektronów w swoim atomie? Do szlachetnego oganu, OG.
Załóżmy, że istnieje element z liczbą kwantową Z równą 119. Następnie jego konfiguracja elektroniczna Valencia wynosiłaby 8s1; Ale jaka byłaby jego pełna konfiguracja elektroniczna?
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6 8s1
A jaka byłaby konfiguracja elektroniczna jądra, kompakt? Ten:
[OG] 8s1
Zwróć uwagę na oczywiste uproszczenie lub skrót. W symbolu [OG] wszystkie 118 elektronów napisanych powyżej jest liczone, więc ten niepewny element ma 119 elektronów, z czego tylko jeden pochodzi z Walencji (byłby zlokalizowany pod Francio w tabeli okresowej).
Może ci służyć: jakie jest nasycone rozwiązanie? (Z przykładami)Przykłady
Ogólny
Załóżmy, że teraz chcesz stopniowo wykonywać skrót:
[On] 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Zauważ, że 1s2 Został zastąpiony przez [on]. Następnym szlachetnym gazem jest neon, który ma 10 elektronów. Wiedząc o tym, skrót trwa:
[Ne] 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Następnie podążaj za argonem z 18 elektronami:
[Ar] 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Ponieważ następnym szlachetnym gazem jest Kripton, zaawansowane jest kolejne 36 elektronów:
[Kr] 5s2 4d10 5 p6 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
Ksenon ma 54 elektrony i dlatego przenosimy skrót do orbity 5p:
[Xe] 6s2 4f14 5 d10 6p6 7s2 5f14 6d10 7p6
W tym momencie konfiguracja elektroniczna jest zawsze skrócona do NP Orbital; To znaczy szlachetne gazy mają te orbitale pełne elektronów. I wreszcie podążaj za radonem z 86 elektronami, więc skrócimy do orbity 6p:
[Rn] 7s2 5f14 6d10 7p6
Tlen
Tlen ma osiem elektronów, co jest pełną konfiguracją elektroniczną:
1s22s22 p4
Jedynym skrótem, którego możemy użyć, jest [on] o 1s2. Zatem jego konfiguracja elektroniczna jądra wynosi:
[On] 2s22 p4
Potas
Potas ma dziewiętnaście elektronów, co jest pełną konfiguracją elektroniczną:
Może ci służyć: skąd pochodzi plastik? Historia i typy1s2 2s2 2 p6 3s2 3p6 4s1
Zauważ, że możemy użyć symbolu [on] do skrótu tej konfiguracji; a także [ne] i [ar]. Ten ostatni jest używany, ponieważ argon jest szlachetnym gazem, który poprzedza go najbliżej potasu. Dlatego jego konfiguracja elektroniczna jądra pozostaje:
[Ar] 4s1
indyjski
Indyjski ma czterdzieści elektronów, co jest pełną konfiguracją elektroniczną:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p1
Ponieważ Kripton jest najbliższym szlachetnym gazem poprzedzającym Indianin, stosuje się symbol [KR] do skrótu, a jego konfiguracja elektroniczna jądra ma:
[Kr] 5s2 4d10 5 p1
Chociaż orbitale 4D nie należą formalnie do jądra indyjskiego, ich elektrony nie interweniują (przynajmniej w normalnych warunkach) w ich wiązaniu metalowym, ale elektromagnety.
Wolfram
Tungsten (lub Wolframio) ma 74 elektrony, a jego pełna konfiguracja elektroniczna to:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 d4
Znowu szukamy najbliższego szlachetnego gazu. W jego przypadku odpowiada Xenón, który ma ukończone orbitale 5p. W ten sposób zastępujemy wiersz notacji kwantowych symbolem [XE] i w końcu będziemy mieć jego konfigurację elektroniczną jądra:
[Xe] 6s2 4f14 5 d4
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Pat Thayer. (2016). Diagramy konfiguracji elektronów. Odzyskane z: chemistryApp.org
- Helmestine, Anne Marie, pH.D. (5 grudnia 2018 r.). Definicja rdzenia gazu szlachetnego. Odzyskane z: Thoughtco.com/
- Wikipedia. (2019). Elektroniczna Konfiguracja. Odzyskane z: jest.Wikipedia.org
- « Uranium Disco History i piosenkarze, którzy go wygrali
- Historia eksperymentu Tuskegee, motywy i krytyka »

