Stężenie chemiczne

- 2289
- 424
- Bertrand Zawadzki
 Stężenie chemiczne określa odsetek substancji rozpuszczonej i rozpuszczalnika w roztworze chemicznym
Stężenie chemiczne określa odsetek substancji rozpuszczonej i rozpuszczalnika w roztworze chemicznym Co to jest stężenie chemiczne?
Stężenie chemiczne Jest to właściwość rozwiązań reprezentujących ilość substancji rozpuszczonej dla każdej jednostki rozwiązania. Innymi słowy, jest to liczba wskazująca odsetek, w którym znajdują się substancja rozpuszczona i rozpuszczalnik.
Przypomnijmy, że roztwór jest jednorodną mieszaniną utworzoną przez rozpuszczalnik (ogólnie ciekła) i jedna lub więcej substancji rozpuszczonych w rozpuszczalniku, którą nazywamy substancjami substancji rozpuszczonych. Rozwiązania charakteryzują się rozpuszczalnikiem, substancją rozpuszczoną i stężeniem.
Koncentracja jest bardzo przydatną właściwością, ponieważ pozwala nam je opisać. Na przykład, jeśli wiemy, że stężenie soli w wodzie morskiej wynosi 35 gramów dla każdego litra, wiemy, że w naszym domu rozpuszczamy 35 gramów soli w litrom roztworu.
Charakterystyka stężenia chemicznego
To intensywna właściwość
Jest to główna cecha koncentracji. Intensywne oznacza, że nie zależy to od ilości mamy rozwiązania. Jako przykład oznacza to, że stężenie jest takie samo w kropli wody morskiej niż w 100 litrach tego samego.
Może się różnić w zależności od temperatury
Zasadniczo ciecze rozwijają się lub zwiększają objętość podczas ogrzewania. Dotyczy to również rozwiązań. Z tego powodu stężenia wyrażone w zależności od objętości mogą nieznacznie zmienić się podczas podgrzewania lub chłodzenia roztworu.
Może obejmować bardzo szerokie zakresy zasięgu
Niezależnie od jednostek, w których wyraża się stężenie chemiczne, może mieć od stosunkowo dużych wartości, do bardzo małych wartości.
Na przykład stężenie roztworu wyrażonego w procentach może mieć wartości od 0% do 100%, obejmując w ten sposób wiele rzędów wielkości. Moglibyśmy przygotować rozwiązanie 90%, ponieważ moglibyśmy również przygotować jeden na 10-12%, czyli prawie 14 rzędów mniejszej wielkości.
Do czego jest stężenie chemiczne?
Znajomość stężenia roztworu pozwala nam to opisać. Istnieje wiele właściwości rozwiązań, które zależą od ich koncentracji. Na przykład temperatura topnienia i wrzenia zależą od stężenia, więc wiedząc, że pozwala nam obliczyć te dwie właściwości.
Może ci służyć: stan sztrowyZ drugiej strony koncentracja pozwala nam łatwo porównać rozwiązanie z innym. Jeśli mamy dwa roztwory wodne z cukrem, znajomość ich koncentracji pozwoli nam wiedzieć, który z nich jest słodszy.
Dodatkowo wszystkie reakcje chemiczne, które umożliwiają życie, zależą silnie od stężenia niekończących się substancji rozpuszczonych w komórkach i otoczenia żywych istot.
Na przykład stężenie tlenu w powietrzu określa, czy dana osoba się udusi, czy nie; PH roztworu (co jest sposobem na pomiar stężenia jonów H+) Ustalić, czy bakterie będą żyć i rozmnażać się, czy też, wręcz przeciwnie, umrze; a koncentracja trucizny określi, czy będzie to śmiertelne, czy nie.
Rodzaje jednostek koncentracyjnych
Stężenie roztworu jest jednym, więc mówienie o rodzajach koncentracji nie jest prawidłowe. Jednak to samo stężenie można wyrazić w różnych typach jednostek stężenia. To są:
- Jednostki koncentracji fizycznej
- Jednostki stężenia chemicznego
Jednostki koncentracji fizycznej
Charakteryzują się wyrażaniem ilości substancji rozpuszczonej i rozpuszczalnika w jednostkach masy lub objętości. Nazywane są jednostkami fizycznymi, ponieważ są one związane z masami i objętościami zamiast moli i równoważnych.
Kiedy porównujemy dwa roztwory o tym samym stężeniu fizycznym, nie możemy upewnić się, że mają one równe ilości atomów i cząsteczek. To właśnie odróżnia ich od jednostek stężenia chemicznego.
Najczęstsze fizyczne jednostki koncentracji to:
- Prosty tytuł (TS)
- %waga/waga (%P/P) lub masa/masa (%m/m)
- %waga/objętość (%P/V) lub masa/objętość (%m/v)
- % objętość/objętość (% v/v)
- Części na milion wagi/wagi (PPMP/P) lub masa/masa (ppmm/m)
- Części na milion wagi/objętości (PPMP/v) lub masa/objętość (PPMM/v)
- Części na milion objętości/objętości (PPMV/v)
Jednostki stężenia chemicznego
W przypadku jednostek chemicznych ilość substancji rozpuszczonej, a w niektórych przypadkach rozpuszczalnika lub roztworu, wyraża się pod względem liczby cząstek lub moli lub równoważników obecnych w roztworze.
Nazywa się je jednostkami chemicznymi, ponieważ dwa roztwory o tym samym stężeniu chemicznym mają równoważne ilości atomów, cząsteczek lub jonów substancji rozpuszczonej na jednostkę roztworu.
Może ci służyć: Zasady rozpuszczalności: ogólne aspekty i zasadyNajczęstsze jednostki chemiczne to:
- Molowa (m)
- Molalność (M)
- Frakcja molowa (x)
- Normalność (N)
Wzór jednostek koncentracji fizycznej
Prosty tytuł (TS)
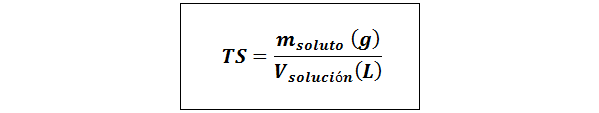
Gdzie msubstancja rozpuszczona reprezentuje masę substancji rozpuszczonej w gramach i vrozwiązanie Jest to objętość rozwiązania w litrach.
%waga/waga (%P/P) lub masa/masa (%m/m)
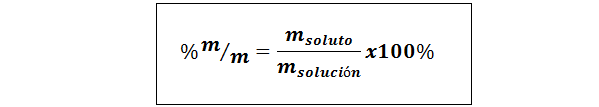
Gdzie msubstancja rozpuszczona oraz mrozwiązanie odpowiednio reprezentują masę substancji rozpuszczonej i roztworu. Można użyć dowolnej jednostki masy (G, Mg, Kg itp.), o ile obie masy są wyrażone w tej samej jednostce.
%waga/objętość (%P/V) lub masa/objętość (%m/v)
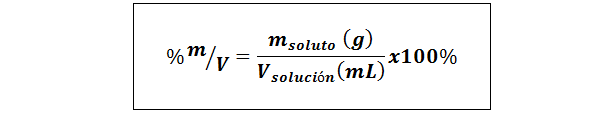
Gdzie msubstancja rozpuszczona Jest to masa roztworu w gramach i vrozwiązanie Jest to objętość rozwiązania, w tym przypadku w mililitrach.
% objętość/objętość (% v/v)

Gdzie vsubstancja rozpuszczona i vrozwiązanie odpowiednio reprezentują objętość substancji rozpuszczonej i rozwiązania. W takim przypadku do wyrażenia tych woluminów można użyć dowolnej jednostki, o ile jest to tak samo dla obu.
Części na milion wagi/wagi (PPMP/P) lub masa/masa (ppmm/m)
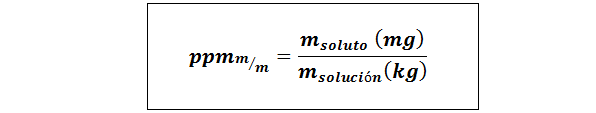
Gdzie msubstancja rozpuszczona oraz mrozwiązanie Reprezentują masę substancji rozpuszczonej i rozwiązania odpowiednio w miligramach i kilogramach.
Części na milion wagi/objętości (PPMP/v) lub masa/objętość (PPMM/v)
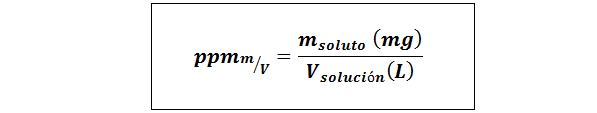
Gdzie msubstancja rozpuszczona Jest to masa rozwiązania w miligramach i vrozwiązanie Jest to objętość rozwiązania, w tym przypadku w litrach.
Części na milion objętości/objętości (PPMV/v)
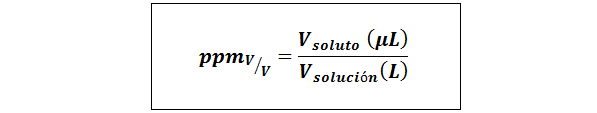
Gdzie vsubstancja rozpuszczona i vrozwiązanie Są to objętość substancji rozpuszczonej i roztworu odpowiednio w mikrolitrach i litrach.
Wzory chemicznych jednostek stężenia
W przypadku jednostek stężenia chemicznego ilość składników roztworu, w szczególności substancji rozpuszczonej, jest wyrażana albo w liczbie moli lub w liczbie równoważników. Ilości te mają rzeczywistą liczbę cząstek (atomy, cząsteczki lub jony, jak to możliwe).
Kwoty te nie mogą być znane po prostu przez ważenie lub mierzenie objętości substancji, ale konieczne jest znanie składu lub wzoru chemicznego związków w celu ustalenia stężenia. To jest główny powód, dla którego nazywane są stężeniami chemicznymi.
Następnie przedstawiono różne wzory w celu obliczenia czterech najczęściej stosowanych stężeń chemicznych:
Molowa (m)
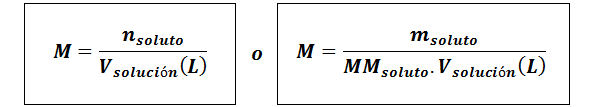
Gdziesubstancja rozpuszczona Są moli substancji rozpuszczonej, msubstancja rozpuszczona reprezentuje masę substancji rozpuszczonej w gramach, mmsubstancja rozpuszczona jest jego masą molową i vrozwiązanie Jest to objętość rozwiązania w litrach.
Molalność (M)
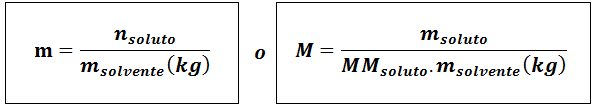
Gdziesubstancja rozpuszczona Są moli substancji rozpuszczonej, msubstancja rozpuszczona reprezentuje masę substancji rozpuszczonej w gramach, mmsubstancja rozpuszczona Jest to jego masa molowa i mrozpuszczalnik Jest to masa rozpuszczalnika w kilogramach.
Może ci służyć: solvationFrakcja molowa (x)
Frakcję molową można obliczyć zarówno dla substancji rozpuszczonej, jak i rozpuszczalnika. Frakcja molowa substancji rozpuszczonej wynosi:
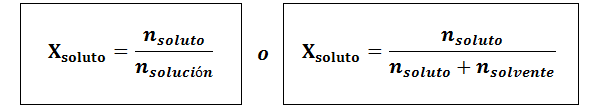
Rozpuszczalnik to:
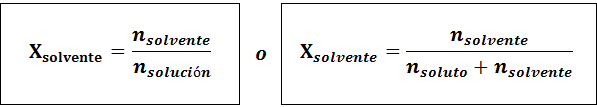
Związek między obiema frakcjami molowymi wynosi:
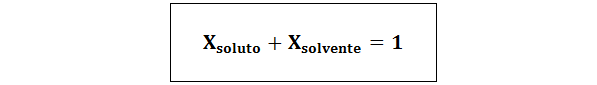
We wszystkich przypadkach nsubstancja rozpuszczona, Nrozwiązanie oraz nrozpuszczalnik są mole odpowiednio substancji rozpuszczonej, roztworu i rozpuszczalnika.
Normalność (N)
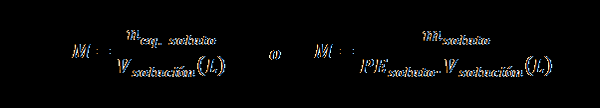
Tutaj nEq. substancja rozpuszczona reprezentuje liczbę odpowiednika substancji rozpuszczonej, msubstancja rozpuszczona reprezentuje masę substancji rozpuszczonej, PEsubstancja rozpuszczona Jest to równoważna waga substancji rozpuszczonej i vrozwiązanie Jest to objętość rozwiązania w litrach.
Przykłady stężenia chemicznego
- Stężenie soli w wodzie morskiej wynosi 35 g/l, co odpowiada molowości 0,60 mol/l.
- Średnie stężenie cukru we krwi wynosi od 82 mg/dl do 110 mg/dl. Stężenia te są równoważne prostemu tytułu przy 0,82 g/l i 1,10 g/l, a w molowości przy 4,4.10-3 Mol/L i 6.1.10-3 odpowiednio mol/l.
- Powietrze można uznać za roztwór gazowy utworzony głównie przez azot i tlen, a rozpuszczalnik to azot, ponieważ jest ono w większej proporcji. Ten roztwór gazowy zawiera 0,22 frakcję tlenu i azotu około 0,78.
- Stal to stop między żelazem a węglem. Chociaż nie są to ściśle rozwiązania, są to jednorodne mieszaniny stałe, które zwykle zawierają stężenie węgla w rzędu 0,03% i 1075% masy.
- Pomimo niszczycielskich skutków dla środowiska i zdrowia ludzi, stężenia wielu zanieczyszczeń są zwykle znacznie niskie. Przykładem jest maksymalne stężenie arsenu trującego metalu w wodzie. Światowa Organizacja Zdrowia (WHO) ustaliła, że woda pitna nie powinna zawierać koncentracji arsenu większej niż 10ppb m/v (części na miliard lub nanogramy na litr). To stężenie jest równoważne 0.010 ppm m/v.
Bibliografia
- BBC (s. F.). Stężenie roztworów - Obliczenia w chemii - AQA - GCSE Chemistry (Single Science) Przegląd - AQA. BBC wzięte.współ.Wielka Brytania.
- Oto, co oznacza koncentracja w chemii (2020). Zatrzymany z Thoughco.com.
- Librettexts (2022). 4.5: Stężenie roztworów. Pobrane z chemii.Librettexts.org.
- Mandal, a., MD. (2021). Normalne wartości cukru we krwi. Zaczerpnięte z wiadomości.internet.
- Chemikalia.Netto (s. F.). Stężenia chemiczne. Zaczerpnięte z chemiki.internet.

