Charakterystyka związków czwartorzędowych, szkolenie, przykłady
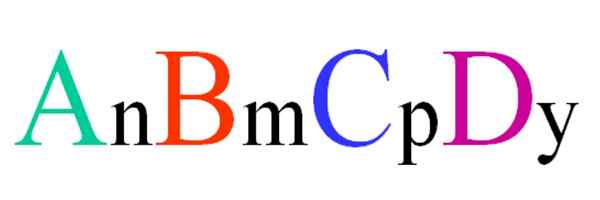
- 1282
- 16
- Eugenia Czapla
Związki czwartorzędowe Są to wszyscy, którzy mają cztery różne atomy lub jony. Dlatego mogą być gatunkami molekularnymi lub jonowymi. Jego różnorodności obejmują chemię organiczną i nieorganiczną, będąc bardzo nieporęczną grupą; Choć być może nie tyle w porównaniu do związków binarnych lub trójskładnikowych.
Powodem, dla którego twój numer jest mniejszy, jest to, że cztery atomy lub jony muszą być zjednoczone przez ich powinowactwa chemiczne. Nie wszystkie elementy są ze sobą kompatybilne, a nawet mniej, gdy są uważane za kwartet; Nagle kilka z nich jest bardziej ze sobą powiązanych niż z drugą parą.
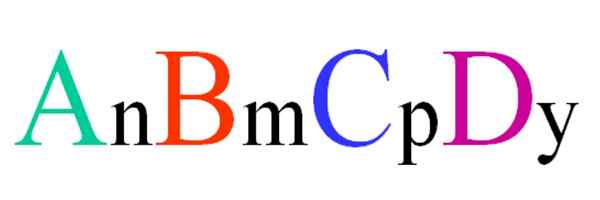 Ogólny i losowy wzór dla związku czwartorzędowego. Źródło: Gabriel Bolívar.
Ogólny i losowy wzór dla związku czwartorzędowego. Źródło: Gabriel Bolívar. Rozważ czwartorzędowy związek losowego wzoru ABCD. Koprzety dolne n, m, p e y, są współczynnikami stechiometrycznymi, które z kolei wskazują, jaki odsetek każdego atomu jest w stosunku do innych.
Zatem formuła ANBMCPDI Będzie to ważne, jeśli spełni elektroneTralność. Ponadto taki związek będzie możliwy, jeśli ich cztery atomy są wystarczająco blisko siebie. Okaże się, że ta formuła nie ma zastosowania do wielu związków, ale szczególnie w przypadku stopów lub minerałów.
[TOC]
Charakterystyka związków czwartorzędowych
Chemikalia
Związek czwartorzędowy może być jonowy lub kowalencyjny, wykazując oczekiwane cechy jego natury. Oczekuje się, że związki jonowe ABCD będą rozpuszczalne w wodzie, alkoholu lub innych rozpuszczalnikach polarnych; Muszą mieć wysokie punkty gotowania i fuzji i być dobrymi sterowcami elektrycznymi, gdy się łączą.
Jeśli chodzi o związki kowalencyjne ABCD, większość składa się z azotu, utlenianych lub halogenicznych związków organicznych; to znaczy, jego formuła stałaby się cNHMALBOPNI lub cNHMALBOPXI, X jest atomem halogenowym. Spośród tych cząsteczek logiczne byłoby myślenie, że były one polarne, biorąc pod uwagę wysokie elektrocielność O, N i X.
Może ci służyć: chlorek sodu (NaCl)Czysto kowalencyjny związek ABCD może mieć wiele możliwości linków: A-B, B-C, D-A itp., W zależności od powinowactwa i możliwości elektronicznych atomów. Podczas gdy w czysto jonowym związku ABCD jego interakcje są elektrostatyczne: a+B-C+D-, Na przykład.
W przypadku stopu, uważanego za bardziej stałą mieszaninę niż właściwie związek, ABCD składa się z neutralnych atomów w stanach podstawowych (teoretycznie).
Reszty związek ABCD może być neutralny, kwasowy lub podstawowy, w zależności od tożsamości jego atomów.
Fizyczny
Mówiąc fizycznie, prawdopodobne jest, że ABCD nie staje się gazem, ponieważ cztery różne atomy zawsze obejmują większą masę cząsteczkową lub formułę. Jeśli nie jest to ciecz o wysokiej temperaturze wrzenia, oczekuje się, że będzie to ciało stałe, którego rozkład musi generować wiele produktów.
Znowu jego kolory, zapach, konsystencja, kryształy itp., Będą podlegać sposobowi współistniejącego A, B, C i D w związku i będą zależeć od ich synergii i struktur.
Nomenklatura
Jak dotąd kwestia związków czwartorzędowych została rozwiązana w globalny i nieprecyzyjny sposób. Odrzucając chemię organiczną na bok (Amidas, chlorki z łazienki, czwartorzędowe sole amonowe itp.), W chemii nieorganicznej istnieją dobrze zdefiniowane przykłady zwane kwaśnymi i podstawowymi oksyzalami.
Kwaśne oksyzały
Kwasowe oksyzale to te, które pochodzą z częściowej neutralizacji polipotycznego oksoacidu. Zatem jeden lub więcej jego hydrogenów jest zastąpionych metalowymi kationami, a im mniej resztkowe wodór, tym mniej kwaśne będzie.
Na przykład kwas fosforowy, H3PO4, Do dwóch soli kwasowych można uzyskać od, jak powiedzieć, sodu. To są: nie2PO4 (Na+ zastępuje wodór równoważny H+) i na2HPO4.
Może ci służyć: selen: historia, właściwości, struktura, uzyskiwanie, użyciaWedług tradycyjnej nomenklatury sole te są nazwane, a także oksisals (całkowicie niechronione), ale poprzedzające słowo „kwas” do nazwy metalu. Tak więc nah2PO4 Byłby to fosforan sodu i na2HPO4 Fosforan kwasu sodu (ponieważ ma H ma.
Z drugiej strony nomenklatura zapasowa woli używać słowa „wodór”, który „kwas”. Nah2PO4 Byłby to dihydrogen sodu i Na2HPO4 Fosforan wodoru sodu. Zauważ, że te sole mają cztery atomy: Na, H, P i O.
Podstawowe oksyzały
Podstawowe oksyzały to te, które zawierają anion OH w ich składzie-. Rozważmy na przykład Salt Cano3Och (CA2+ NIE3- Oh-). Aby to wymienić, wystarczy, aby nadać słowo „podstawowe” nazwę metalu. Zatem nazywałby się: Podstawowy azotan wapnia. A co z Cuio3Oh? Nazywałby się: Cupric Basic Yodato (Cu2+ Io3- Oh-).
Według nomenklatury zapasowej słowo „podstawowe” zastępuje się wodorotlenkiem, a następnie użycie skryptu przed nazwą oksoanionu.
Powtarzanie poprzednich przykładów ich nazwy byłoby dla każdego: wodorotlenek wodorotlenku wapnia i wodorotlenek miedzi (ii); Pamiętając, że metalowa Walencja musi być wskazana w nawiasach i liczbach rzymskich.
Podwójne sole
W podwójnych sole istnieją dwa różne kationy oddziałujące z tym samym typem anionu. Załóżmy, że podwójna sól: cu3Wiara (Po4)3 (Cu2+ Wiara3+ PO43-). Jest to żelazo i fosforan miedzi, ale najbardziej odpowiednią nazwą do tego jest: potrójna miedź (ii) i żelazo (iii) fosforan.
Nawodnione sole
Są to hydraty, a jedyną różnicą jest to, że na końcu ich nazw określono liczbę formuli wody. Na przykład MNCL2 Jest to chlorek manganu (ii).
Może ci służyć: benzoina: struktura, właściwości, zastosowania i ryzykoJego hydrat, MNCL2· 4H2O Nazywa się to chlorek manganu (ii) tetrahydrat. Zauważ, że istnieją cztery różne atomy: MN, CL, H i O.
Słynna podwójna i uwodniona sól to Mohr, wiara (NH4)2(POŁUDNIOWY ZACHÓD4)2· 6H2ALBO. Nazywa się: podwójny siarczan żelaza (ii) i heksahydrate amon.
Szkolenie
Ponownie, koncentrując się na nieorganicznych związkach czwartorzędowych, mamy głównie produkt częściowych neutralizacji. Jeśli występują one w obecności kilku tlenków metali, prawdopodobne są podwójne sole; A jeśli medium jest bardzo podstawowe, podstawowe oksyzały wytrącą.
A jeśli dodatkowo, z drugiej strony, cząsteczki wody mają powinowactwo do metalu, będą one bezpośrednio koordynować z nim lub z otaczającymi jonami, tworząc hydraty.
Z boku stopów należy przyspawać cztery różne metale lub metaloidy do produkcji kondensatorów, półprzewodników lub tranzystorów.
Przykłady
Wreszcie lista z różnymi przykładami związków czwartorzędowych pokazano poniżej. Czytelnik może go wykorzystać do przetestowania swojej wiedzy na temat nomenklatury:
- PBCO3(OH)2
- CR (HSO4)3
- Nahco3
- ZNIOH
- Cu2(OH)2południowy zachód3
- Li2Kaso4
- Cuso4· 5H2ALBO
- Agau (więc4)2
- Sprawa4· 2H2ALBO
- Fecl3· 6H2ALBO
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Nomenklatura nieorganiczna i sformułowanie. [PDF]. Źródło: Zasoby.Edukacja.Jest
- Erika Thalîa Dobra. (2019). Podwójne sole. Akademia. Odzyskane z: Akademia.Edu
- Wikipedia. (2019). Czwartorzędowy kation amonowy. Źródło: w:.Wikipedia.org

