Charakterystyka, szkolenie, przykłady
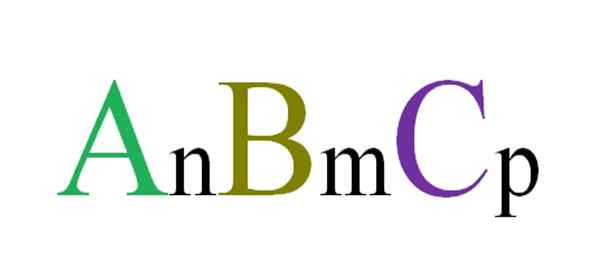
- 695
- 136
- Marianna Czarnecki
Związki trójskładnikowe Są to wszystkie, które składają się z trzech różnych atomów lub jonów. Mogą być bardzo zróżnicowane, od kwasu lub podstawowych substancji, po stopy metali, minerałów lub nowoczesnych materiałów. Trzy atomy mogą należeć do tej samej grupy stolika okresowej lub kontynuować arbitralne lokalizacje.
Jednak, aby występował związek trójskładnikowy, musi istnieć powinowactwo chemiczne między jego atomami. Nie wszystkie są ze sobą kompatybilne, dlatego nie można po prostu losowo wybrać, które trzy zintegrują i zdefiniują związek lub mieszaninę (zakładając brak wiązań kowalencyjnych).
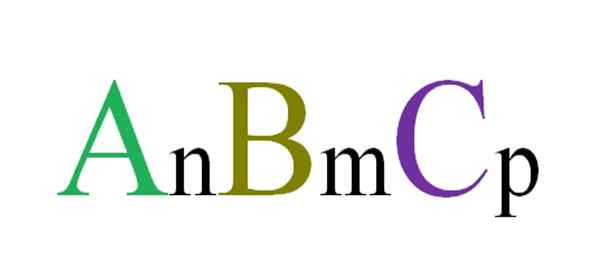 Ogólny i losowy wzór dla związków trójskładnikowych. Źródło: Gabriel Bolívar.
Ogólny i losowy wzór dla związków trójskładnikowych. Źródło: Gabriel Bolívar. Na przykład losowo wybierane są trzy litery, które będą rządzić związek trójskładnikowy ABC (obraz doskonały). Koprzety dolne N, M i P wskazują na stechiometryczne związki między atomami lub jonami A, B i C. Zmieniając wartości takich dolnych i tożsamości liter, uzyskuje się nieskończone związki trójskładnikowe.
Jednak formuła ANBMCP Będzie to ważne tylko wtedy, gdy spełni elektroneStralność; Oznacza to, że suma twoich ładunków musi być równa zero. Mając to na uwadze, istnieją fizyczne (i chemiczne) ograniczenia, które prowadzą, czy możliwe jest tworzenie wspomnianego związku trójskładnikowego.
[TOC]
Charakterystyka związków trójskładnikowych
Jego cechy nie są ogólne, ale różnią się w zależności od ich chemicznego charakteru. Na przykład oksoacidy i zasady są związkami trójskładnikowymi, a każdy z nich dzieli lub nie jest serią reprezentatywnych cech.
Teraz, przed hipotetycznym związkiem ABC, może to być jonowe, jeśli różnice elektroungatywności między A, B i C nie są duże; lub kowalencyjne, z linkami A-B-C. Te ostatnie podano w nieskończonych przykładach w chemii organicznej, jak w przypadku alkoholi, fenoli, eterów, węglowodanów itp., którego wzory można opisać za pomocą CNHM ALBOP.
Może ci służyć: właściwości mechaniczne metaliZatem cechy są bardzo zróżnicowane i oscylują w wysokim stopniu jednego związku trójskładnikowego do drugiego. Związek cNHMALBOP Mówi się, że jest natleniony; podczas gdy cNHMNP, Z drugiej strony jest to azot (to amina). Inne związki mogą być siarki, fosforowane, fluoryzowane lub mieć wyraźny charakter metaliczny.
Podstawy i kwasy
Postępując w dziedzinie chemii nieorganicznej, masz metalowe podstawy, mNALBOMHP. Dawać.
Na przykład baza NaOH, biorąc pod uwagę takie indeksywach, powinna być napisana jako Na1ALBO1H1 (co byłoby chaotyczne). Ponadto zakłada się, że H jest kationem h+, I nie tak, jak to się wydaje: bycie częścią anionu oh-. Z powodu działania OH- Na skórze podstawy te są mydłem i żrące.
Metalowe zasady są substancjami jonowymi i chociaż składają się z dwóch jonów, mN+ I och- (Na+ I och- Dla NaOH) są to trójskładniki do posiadania trzech różnych atomów.
Kwasy z drugiej strony są kowalencyjne, a ich ogólną formułą jest hao, gdzie zwykle jest atom niemetaliczny. Jednak biorąc pod uwagę jego łatwość jonizowanego w wodach zwalniających hydrogeny, jego jony H+ Corroen i zranił skórę.
Nomenklatura
Podobnie jak cechy, nomenklatura związków trójskładnikowych jest bardzo zróżnicowana. Z tego powodu tylko zasady, okacidy i oksyzale będą uważane za powierzchownie.
Bazy
Najpierw wspomniane są metalowe podstawy słowem „wodorotlenek”, a następnie nazwa metalu i jego wartościowości w liczbach rzymskich w nawiasach. Zatem NaOH to wodorotlenek sodu (i); Ale ponieważ sód ma unikalną wartościowość +1, pozostaje po prostu jako wodorotlenek sodu.
Może ci służyć: AlceanowieAL (OH)3, Na przykład jest to wodorotlenek glinu (III); i Cu (OH)2, wodorotlenek miedzi (ii). Oczywiście wszystko według systematycznej nomenklatury.
Oxoacids
Oxóacids mają dość ogólną formułę typu HAO; Ale w rzeczywistości są lepiej opisane jako AOH. Pojawia się link HA-H, H jest wydany+.
Tradycyjna nomenklatura jest następująca: zaczyna się słowo „kwas”, a następnie nazwa atomu centralnego, poprzedzona lub poprzedzoną ich odpowiednimi prefiksami (hipo, per) lub sufiksami (niedźwiedź, ICO), w zależności od tego, czy pracuje ze swoimi menatorami lub starsze wartościowości.
Na przykład bromacydy to HBRO, HBRO2, Hbro3 i Hbro4. Są to kwasy: odpowiednio hipobromie, bromowe, bromowe i oksarne. Zauważ, że we wszystkich z nich istnieją trzy atomy o różnych wartościach dla ich dolnych indeksu.
Oxisals
Zwane również solami zerowymi, są one najbardziej reprezentatywne dla związków trójskładnikowych. Jedyną różnicą, o której warto wspomnieć, jest to, że niedźwiedź i ICO Sufijos zmieniają się odpowiednio dla ITO i ATO. Ponadto H jest zastępowane kationem metalu, produktem neutralizacji kwasowo-zasadowej.
Kontynuując brom, jego oksyzały sodu byłyby: Nabro, Nabro2, Nabro3 i Nabro4. Ich nazwy stałyby się: Hipobromito, Bromito, Bromato i perbrominian sodu. Bez wątpienia liczba możliwych oksisali przekracza liczbę oksoacidów.
Szkolenie
Ponownie, każdy rodzaj związku trójskładnikowego ma własny proces pochodzenia lub szkolenia. Można jednak wspomnieć, że można je uformować tylko wtedy, gdy istnieje wystarczające powinowactwo między trzema członkami atomów. Na przykład podstawy metalowe istnieją dzięki interakcjom elektrostatycznym między kationami a OH-.
Może ci służyć: kwas cytrynowyCoś podobnego dzieje się z kwasami, których nie można było utworzyć, gdyby nie było takiego kowalencyjnego wiązania A-O-H.
Na podstawie pytania, w jaki sposób powstają główne związki? Bezpośrednia odpowiedź jest następująca:
- Podstawy metalowe powstają przez rozpuszczenie tlenków metali w wodzie lub w roztworze alkalicznym (zwykle dostarczanym przez NaOH lub amoniak).
- Oxoacidy są produktem rozpuszczania tlenków niemetalicznych w wodzie; Wśród nich CO2, Clo2, NIE2, południowy zachód3, P4ALBO10, itp.
- A następnie oksyzały powstają, gdy okacidy są alkalizowane lub zneutralizowane metalową podstawą; Z niego wychodzą metalowe kationów, które dostarczają h+.
Inne trójskładnikowe związki powstają po bardziej skomplikowanym procesie, jak w przypadku niektórych stopów lub minerałów.
Przykłady
Wreszcie seria formuł dla różnych związków trójskładnikowych zostanie pokazana jako lista:
- Mg (OH)2
- CR (OH)3
- Kmno4
- Na3Bo3
- CD (OH)2
- Starszy brat3
- Feaso4
- Bacr2ALBO7
- H2południowy zachód4
- H2Teo4
- Hcn
- Agoh
Inne mniej powszechne (a nawet hipotetyczne) przykłady to:
- Cofecu
- Algasn
- UCAPB
- Bemgo2
Kopryty dolne N, M i P zostały pominięte, aby nie komplikować wzorów; Chociaż w rzeczywistości jego współczynniki stechiometryczne (z wyjątkiem najlepszych dla Bemgo2), może nawet mieć wartości dziesiętne.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- PANI. Hilfstein. (S.F.). TERNERARY COMUNUNDS. Odzyskane z: Tenafly.K12.NJ.nas
- Wikipedia. (2019). TERNERARY COMUND. Źródło: w:.Wikipedia.org
- Carmen Bello, Arantxa Isasi, Ana Puerto, Germán Tomás i Ruth Vicente. (S.F.). Związki trójskładnikowe. Odzyskane z: iesdmjac.Edukacja.Aragon.Jest
- « Charakterystyka związków czwartorzędowych, szkolenie, przykłady
- Specjalne cechy związków, szkolenie, zastosowania »

