Struktura chlorku miedzi (I) (CUCL), właściwości, zastosowania
- 653
- 21
- Estera Wojtkowiak
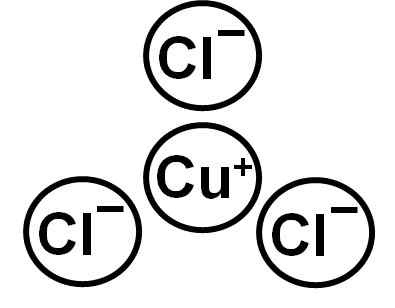
On Chlorek miedzi (i) Jest to związek nieorganiczny utworzony przez miedź (Cu) i chloru (CL). Jego formuła chemiczna jest cucl. Miedź w tym związku ma walencję +1 i chloru -1. Biała krystaliczna substancja stała, która po wystawieniu długiego czasu w powietrzu nabiera zielonkawego zabarwienia z powodu utleniania miedzi (i) do miedzi (ii).
Zachowuje się jak kwas Lewisa potrzebujący elektronów innych związków, które są zasadami Lewisa, z których tworzą złożone lub stabilne addukty. Jednym z tych związków jest tlenek węgla (CO), więc zdolność do przyłączenia się między nimi jest wykorzystywana przemysłowo do wydobywania CO napojów bezalkoholowych.
 Oczyszczony chlorek miedzi (I) (CUCL). Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Oczyszczony chlorek miedzi (I) (CUCL). Leiem/cc by-sa (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Ma właściwości optyczne, które można stosować w półprzewodnikach emitujących światło. Ponadto nanokubry CUCL mają duży potencjał do wykorzystania w wydajnych urządzeniach energetycznych.
Jest używany w sztuce pirotechniki, ponieważ w kontakcie z płomieniem wytwarza niebieskawe zielone światło.
[TOC]
Struktura
CUCL jest uformowany przez jon Cuproso Cup+ i anion chlorek CL-. Konfiguracja elektroniczna Cu+ Jest:
1s2 2s2 2 p6 3s2 3p6 3d10 4s0
I to dlatego, że miedź straciła elektron warstwy 4S. Jon chlorkowy ma konfigurację:
1s2 2s2 2 p6 3s2 3p6
Można zauważyć, że oba jony mają pełne warstwy elektroniczne.
Ten związek krystalizuje się z symetrią sześcienną. Na poniższym obrazku obserwuje się rozmieszczenie atomów w jednostce krystalicznej. Różowe kule odpowiadają miedzi i zielonym kulom z chlorem.
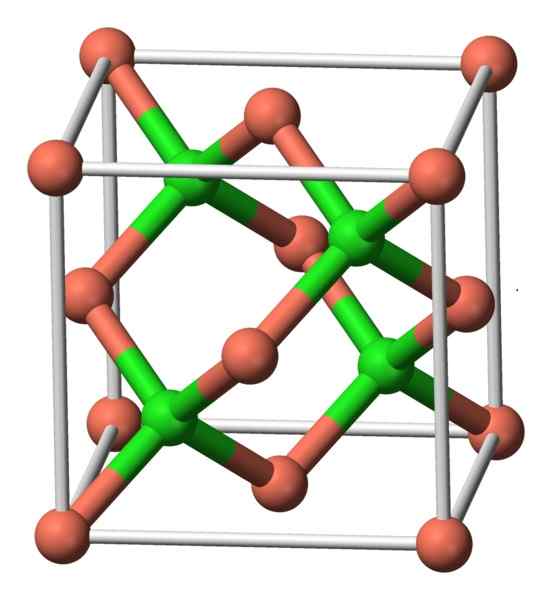 Struktura CUCL. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Struktura CUCL. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Nomenklatura
- Chlorek miedzi (i)
- Chlorek miedzi
- Miedziany monoklorek
Nieruchomości
Stan fizyczny
Krystaliczna biała substancja stała, która w przedłużonym powietrzu z powietrzem jest utleniona i zmienia zieloną.
Waga molekularna
98,99 g/mol
Temperatura topnienia
430 ° C
Punkt wrzenia
Około 1400 ° C.
Gęstość
4 137 g/cm3
Rozpuszczalność
Prawie nierozpuszczalne w wodzie: 0,0047 g/100 g wody w 20 ° C. Nierozpuszczalny w etanolu (c2H5Och) i aceton (wybierz3(C = O) CH3).
Może ci służyć: Alilo: Allyic Unit, Carbocation, Radical, przykładyWłaściwości chemiczne
Jest niestabilny w powietrzu, ponieważ Cu+ ma tendencję do utleniania Cu2+. Z czasem tlenek kubkowy (CUO), wodorotlenek miedzi (CUOH) lub złożony oksychlorek i sól są zielone.
 Chlorek miedzi (i), który został narażony na środowisko i częściowo utleniony. CuOH, CuOH i inne związki mogą zawierać. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons.
Chlorek miedzi (i), który został narażony na środowisko i częściowo utleniony. CuOH, CuOH i inne związki mogą zawierać. Benjah-BMM27 / Public Domena. Źródło: Wikimedia Commons. W roztworze wodnym jest również niestabilny, ponieważ występuje jednocześnie utlenianie i reakcja redukcji, tworząc metaliczną miedź i jon miedzi (II):
CUCL → Cu0 + Cucl2
CUCL jako kwas Lewis
Ten związek działa chemicznie jako kwas Lewis, co oznacza, że jest chętny do elektronów, więc tworzy stabilne addukty z związkami, które mogą je zapewnić.
Jest bardzo rozpuszczalny w kwasie solnym (HCl), gdzie jony CL- Zachowują się, gdy powstają dawcy elektronów i gatunki, takie jak CUCL2-, Cucl32- i Cu2Cl42-, m.in.
 Jest to jeden z gatunków utworzonych w roztworach CUCL w HCL. Autor: Marilú Stea.
Jest to jeden z gatunków utworzonych w roztworach CUCL w HCL. Autor: Marilú Stea. Wodne roztwory CUCL mają zdolność wchłaniania tlenku węgla (CO). Ta absorpcja może wystąpić, gdy roztwory te są zarówno kwasowe, jak i neutralne lub z amoniakiem (NH3).
W takich rozwiązaniach szacuje się, że powstają różne gatunki, takie jak Cu (CO)+, Kukułka)3+, Kukułka)4+, CUCL (CO) i [Cu (CO) CL2]-, który zależy od medium.
Inne właściwości
Ma charakterystykę elektrooptyczną, niską stratę optyczną w szerokim zakresie widma świetlnego od widzialnego do podczerwieni, niskiego wskaźnika refrakcji i stałego dielektrycznego niskiego.
Uzyskanie
Chlorek miedzi (I) można uzyskać przez reakcję metalowej miedzi bezpośrednio z gazem chloru w temperaturze 450-900 ° C. Ta reakcja ma zastosowanie przemysłowo.
2 cu + cl2 → 2 Cucl
Możesz także użyć związku zmniejszającego, takiego jak kwas askorbinowy lub dwutlenek siarki do przekazywania chlorku miedzi (II) do chlorku miedzi (I). Na przykład w przypadku SO2, Jest to utleniane do kwasu siarkowego.
2 Cucl2 + południowy zachód2 + 2 godz2O → 2 cucl + h2południowy zachód4 + 2 HCl
Aplikacje
W procesach Co -Rekorium
Zdolność roztworów pochłaniających i wewnętrznych.
Może ci służyć: turbidymetriaNa przykład proces zwany COSORB wykorzystuje stabilizowany chlorek miedzi w postaci złożonej soli z aluminium (AnyCl4), który rozpuszcza się w aromatycznym rozpuszczalniku, takim jak toluen.
Roztwór pochłania CO prądu gazowego, aby oddzielić go od innych gazów, takich jak CO2, N2 i rozdz4. Następnie roztwór bogaty w tlenek jest ogrzewany pod zmniejszonym ciśnieniem (to znaczy niższy niż atmosfery), a CO jest egzorg. Gaz odzyskany w ten sposób jest wysoką czystością.
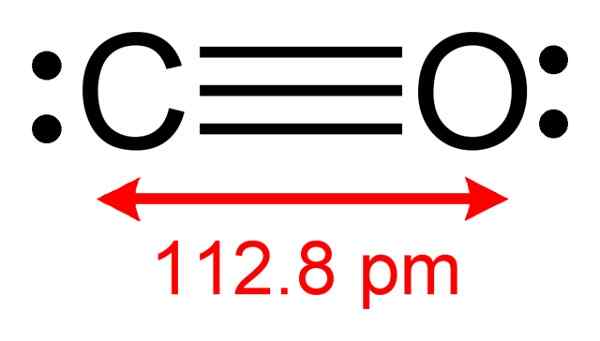 Obserwuje się strukturę tlenku węgla, w której dostępne są elektrony do tworzenia kompleksu z CUCL. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Obserwuje się strukturę tlenku węgla, w której dostępne są elektrony do tworzenia kompleksu z CUCL. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Ten proces pozwala uzyskać czystą CO.
O katalizie
CUCL jest stosowany jako katalizator do różnych reakcji chemicznych.
Na przykład reakcja pierwiastka Germano (GE) z chlorkiem wodoru (HCl) i etylenem (CH2= Ch2) można wykonać za pomocą tego związku. Służy również do syntezy organicznych związków krzemowych i różnych heterocyklicznych pochodnych organicznych siarki i azotu.
Możesz zsyntetyzować polimer polifenileneter. Ten polimer jest bardzo przydatny ze względu na jego właściwości mechaniczne, niewielkie wchłanianie wilgoci, doskonałą izolację elektryczności i odporność na ogień.
W uzyskiwaniu organicznych związków miedzi
Związki alkenilcupratato można przygotować, reagując na końcową alkę.
Przy pozyskiwaniu polimerów zjednoczonych z metali
Chlorek miedzi (I) może być skoordynowany z polimerami tworzącymi złożone cząsteczki, które służą jako katalizatory i łączą prostotę heterogenicznego katalizatora z regularnością jednorodnego.
W półprzewodnikach
Związek ten jest stosowany do uzyskania materiału utworzonego przez γ-corpu na krzemowym.
Materiały te mają szerokie zastosowanie w diodach emitujących światło ultrafioletowe, diodach laserowych i detektorach światła.
Może ci służyć: bromek potasu (KBR): Struktura, właściwości, zastosowaniaU super karty
Produkt uzyskany w postaci nanocząstek sześciennych lub nanokubów pozwala na wytwarzanie superkaderów, ponieważ ma znaczącą prędkość obciążenia, wysoką odwracalność i niewielką utratę pojemności.
Supercorders to urządzenia do przechowywania energii, które wyróżniają się ich wysoką gęstością mocy, działalności, cykli szybkiego ładowania i rozładowania, stabilność długoterminowej i są przyjazne dla środowiska.
 Nanocubos CUCL może być stosowany w aplikacjach elektronicznych i magazynowania energii. Autor: Tide on. Źródło: Pixabay.
Nanocubos CUCL może być stosowany w aplikacjach elektronicznych i magazynowania energii. Autor: Tide on. Źródło: Pixabay. Inne aplikacje
Dawać.
 Zielony kolor niektórych fajerwerków może wynikać z chrapania. Autor: Hans Braxmeier. Źródło: Pixabay.
Zielony kolor niektórych fajerwerków może wynikać z chrapania. Autor: Hans Braxmeier. Źródło: Pixabay. Bibliografia
- Milek, J.T. i Neuberger, m. (1972). Chlorek miedzi. W: liniowe elektrooptycznych materiałów modułowych. Springer, Boston, MA. Link odzyskał.Skoczek.com.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Sneeden, r.P.DO. (1982). Metody absorpcji/dezorpcji. W kompleksowej chemii organetalicznej. Tom 8. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Chandrashekhar, v.C. i in. (2018). Ostatnie postępy w bezpośredniej syntezie związków organometalicznych i koordynacyjnych. W bezpośredniej syntezy kompleksów metali. Odzyskane z naukowym.com.
- Kyushin, s. (2016). Synteza organoborconu do budowy klastrów organokiliconowych. W wydajnych metodach przygotowania związków krzemu. Odzyskane z naukowym.com.
- Van Koten, G. i noltes, j.G. (1982). Związki organokopperów. W kompleksowej chemii organetalicznej. Głośność 2. Odzyskane z naukowym.com.
- Danieluk, zm. i in. (2009). Właściwości optyczne nieopływających i domieszkowanych tlenami filmów CUCL na sublicu krzemowym. J Mater Sci: Mater Electron (2009) 20: 76-80. Link odzyskał.Skoczek.com.
- Yin, ur. i in. (2014). Nanokube chlorkowe hodowane na elektrodach pseudokapacitor. Nano-Micro Lett. 6, 340-346 (2014). Link odzyskał.Skoczek.com.
- Kim, k. i in. (2018). Bardzo wydajny aromatyczny chlor ligand/miedzi (i). Polymers 2018, 10, 350. MDPI odzyskało.com.
- Wikipedia (2020). Chlorek miedzi (i). Odzyskane z.Wikipedia.org.
- « Ułamek molowy sposób obliczania, przykłady, ćwiczenia
- Uzyskiwanie tłuszczu butyrycznego, typy, skład, zastosowania, korzyści »

