Chlorek aluminiowy (ALCL3)
- 4865
- 76
- Eugenia Czapla
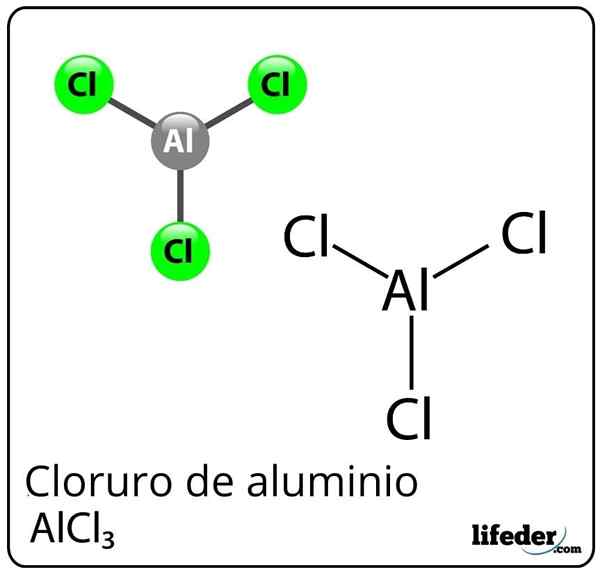
 Wzór i struktura chlorku aluminiowego
Wzór i struktura chlorku aluminiowego Co to jest chlorek aluminiowy?
On Chlorek aluminiowy Jest to nieorganiczny związek chemiczny, którego wzorem jest ALCL3. Jest przedstawiany jako stały lub biały pyłu, chociaż z powodu zanieczyszczenia chlorkiem żelazowym i wilgocią może stać się żółty. Składa się z kwasu Lewisa, ale w pewnych okolicznościach zachowuje się również jako baza Lewisa.
Pomimo aluminium jako metalu w stole okresowym, występuje kowalencyjne wiązanie między aluminium a chlorem z utworzeniem chlorku aluminiowego.
To kowalencyjne wiązanie może wyjaśnić, dlaczego stopiony chlorek aluminiowy jest złym przewodnikiem energii elektrycznej; Podczas gdy stopione sole innych związków, takie jak chlorek sodu, są dobrymi przewodnikami energii elektrycznej.
Chlorek aluminiowy powstaje przez reakcję egzotermiczną między glinem a chlorem lub chlorkiem wodoru w temperaturze od 650 do 750 ° C.
Chlorek aluminiowy jest stosowany jako antitranspirant i do walki z nadmiernym poceniem. Jedna z jego pochodnych jest wykorzystywana jako czynnik koagulantowy w oczyszczaniu ścieków przemysłowych i jest również stosowany jako główny katalizator w reakcjach chemicznych branży.
Struktura chlorku aluminiowego
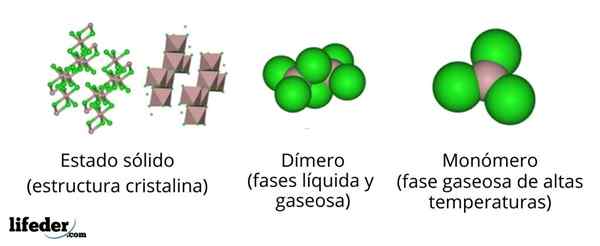
Na górnym obrazie mamy różne reprezentacje dla każdej ze struktur krystalicznych lub molekularnych, które wykazują bezwodny chlorek glinu, ALCL3, W kilku jego stanach fizycznych.
ALCL3 Solid składa się z monoklinicznej struktury krystalicznej utworzonej przez warstwy okaedros koordynowanych ze sobą. W tych oktahedrze (kolor brązowy), jon to3+ Jest koordynowany z sześcioma jonami CL-, Działając chlorkami jako mosty między dwoma oktaedrami.
Gdy temperatura wzrasta i zostanie założona Alll3, Warstwy są podzielone na jednostki na2Cl6 (Centrum obrazu). Teraz atom aluminiowy tworzy połączenia z trzema atomami chloru i łączem z innym atomem aluminiowym: CL3Al-alcl3. Te dimery wyjaśniają, dlaczego ALCL3 stopione jest mniej gęste niż jego kryształy.
Może ci służyć: gadolinio: struktura, właściwości, uzyskiwanie, użyciaW fazie pary dimery do2Cl6 Dystansują się nawzajem. Ale jeśli ta para jest poddawana wysokim temperaturom, dimer dysocjuje w jednostkach molekularnych ALCL3, w którym atom aluminiowy tworzy trzy połączenia z atomami chloru. ALCL3 przedstawia trygonalną płaską geometrię.
Aluminiowe właściwości chlorkowe
 Stała próbka chlorku aluminiowego z żółtawymi tonami. Źródło: Xlollitox, CC przez 3.0, Via Wikimedia Commons
Stała próbka chlorku aluminiowego z żółtawymi tonami. Źródło: Xlollitox, CC przez 3.0, Via Wikimedia Commons Formuły
Alcl3 (bezwodny)
Alcl3· 6H2O (heksahydrate)
Masa cząsteczkowa
133.34 g/mol (anhydro)
241.43 g/mol (heksahydrat)
Wygląd fizyczny
Krystaliczny stały lub biały kurz. Może stać się żółtawy odcieniem z powodu zanieczyszczenia chlorkiem żelazowym. Możesz także zmienić na szarawy kolor dla wilgoci.
Temperatura topnienia
192.4 ° C
Punkt wrzenia
Sublima w 178 ° C, więc nie jest łatwo uzyskać temperaturę wrzenia chlorku aluminiowego.
Gęstość
2.48 g/cm3 (bezwodny)
2.398 g/cm3 (Hexahydrate)
Rozpuszczalność wody
439 g/l A 0 ºC
458 g/l w 20 ° C
466 g/l A 30 ºC
Chlorek aluminiowy to higroskopowy związek, który może wchłonąć mokrą wodę powietrzną, emitującą dym podczas procesu.
Rozpuszczalność w innych rozpuszczalnikach
Rozpuszczalny etanol, chloroform, tetrachlorek węgla, benzofenon i nitrobenzen. Lekko rozpuszczalne w benzenu.
Ciśnienie pary
13.3 kPa przy 151 ° C (0.131 atm).
Breja
0.35 CP do 197 ºC
Reaktywność
Chlorek aluminiowy jest substancją amfotanową, to znaczy zachowuje się jak kwas lub zasada. Jednak jego działanie jako kwasu jest przeważające, ponieważ chlorek glinu jest stosowany jako kwas Lewis, a jednocześnie jest katalizatorem w wielu reakcjach chemicznych; Wśród nich reakcja Friedel-Craftsa.
Może ci służyć: neodym: struktura, właściwości, użyciaNawet chlorek aluminiowy jest klasyfikowany jako kwas, zamiast robić to jako sól.
Bezwodny chlorek aluminiowy w roztworze wodnym przekształca się w sól sześciokadrową (ALCL3· 6H2O), który nie wraca do postaci bezwodnej przez rozgrzewanie.
Aluminiowe atomy dwóch cząsteczek ALCL3 Oddziałują ze sobą, aby ukończyć 8 elektronów w ich warstwie walencyjnej, co powoduje powstawanie dimeru do2Cl6. Ten dimer jest obecny w stopionym chlorku aluminiowym i pary.
Chlorek aluminiowy reaguje z wodorotlenkiem sodu z tworzeniem wodorotlenku aluminiowego, galaretowatego osadu:
Alcl3 + Naoh → AL (OH)3 + 3 NaCl
Zastosowania chlorków aluminiowych
Antytranspirant i antyhemorrhagiczne
 Chlorek aluminiowy jest częścią składników stosowanych w preparatach kilku dezodorantów. Źródło: Th145, CC BY-SA 2.0, Via Wikimedia Commons
Chlorek aluminiowy jest częścią składników stosowanych w preparatach kilku dezodorantów. Źródło: Th145, CC BY-SA 2.0, Via Wikimedia Commons Chlorek aluminiowy jest stosowany jako antitranspirant w osobistych dezodorantach, a także stosuje się do kontrolowania nadmiernego pocenia się (hiperhidroza). Jest również stosowany w preparatach do kontrolowania małych krwawień, takich jak te prezentowane w zabiegach dentystycznych.
Oczyszczanie ścieków
Chlorek aluminiowy w postaci PAC (chlorek poliuluminy) jest stosowany jako koagulant w oczyszczaniu ścieków przemysłowych, ze względu na jego zdolność do wyjaśnienia wody i szlamu odwadnianego.
Katalizator
Chlorek aluminiowy jest jednym z głównych katalizatorów stosowanych w branży, działając jako katalizator w wielu reakcjach, w tym Friedel-Crafts.
Może ci służyć: Europium: Struktura, właściwości, uzyskiwanie, zastosowaniaAluminiowy chlorek katalizuje reakcje przygotowania antraquinonów, z których niektóre są używane w przemyśle tekstylnym. Istnieją również antraquinony, które mają właściwości przeciwbakteryjne, antyparasetyczne, grzybobójcze i przeciwwirusowe.
Chlorek glinu katalizuje reakcje wytwarzane przez dodecilbenzen, stosowane w produkcji detergentów i etylobenzenu, związek stosowany w produkcji polistyrenu, polimeru stosowanego w opracowaniu tworzyw sztucznych, żywic i gumowej.
Chlorek aluminiowy jest również stosowany jako katalizator w reakcji, która jest częścią wysokiej wytwarzania benzyny oktanowej. Podobnie katalizuje proces pękania oleju.
Ryzyko
Chlorek aluminiowy jest substancją żrącą, a jej kontakt może powodować podrażnienie oraz urazy skóry i oczu, powodując uszkodzenie oczu.
Podczas rozpuszczania się w wodzie można uwolnić trujące gazy, takie jak chlorek wodoru; Gazy zdolne do wdychania podrażnienia nosa i gardła, możliwe powodowanie twardego i podrażnienia płucnego. To podrażnienie może prowadzić do akumulacji płynu w płucach (obrzęk płuc), który kończy się w nagłych wypadkach.
Próbował nawiązać związek między chorobą Alzheimera a chlorkiem aluminiowym; Chociaż wyniki badań nie są rozstrzygające.
Podobnie zbadano połączenie między użyciem dezodorantów, których używają jako anty -transspirant z Alll3 i rak piersi. Badania nie były w stanie wykazać rozstrzygającego związku. W każdym razie chlorek aluminiowy blokuje działanie naturalnego systemu detoksykacji organizmu i emisji ciepła, takiego jak pot.
Bibliografia
- Wikipedia. (2021). Aluminium chlorkowe. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information (2021). Aluminium chlorkowe, podsumowanie związku Pubchem dla CID 24012. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- NJ Health. (2008). Arkusz faktów dotyczących substancji niebezpiecznej: chlorek glinowy. [PDF]. Odzyskane z: NJ.Gov
- Britannica Encyclopaedia. (2021). Aluminium chlorkowe. Odzyskane z: Britannica.com
- Elsevier b.V. (2021). Antraquinones. Scientedirect. Pobrano z: Scientedirect.com
- John P. Cunha. (02 maja 2020). Miejscowe chlorkowe glin. Odzyskany z: rxlist.com

