Struktura kwasu jodhydowego (HI) właściwości i zastosowania

- 4691
- 225
- Arkady Sawicki
On Kwas iarhydralny Jest to wodny roztwór jodku wodoru, który charakteryzuje się jego wysoką kwasowością. Definicja bardziej przywiązana do terminologii chemicznej i IUPAC polega na tym, że jest to hydrayst.
Jednak, aby odróżnić go od gazowych cząsteczek jodku wodoru, HI (G), jest on oznaczony jako HI (AC). Z tego powodu w równaniach chemicznych ważne jest zidentyfikowanie środowiska lub fazy fizycznej, w której odczynniki i produkty były. Mimo to zamieszanie między jodkiem wodoru i kwasem iarchlorowym są zwykle powszechne.
 Jony kwasu iarhydric. Źródło: Gabriel Bolívar.
Jony kwasu iarhydric. Źródło: Gabriel Bolívar. Jeśli zaobserwowane są zaangażowane cząsteczki w ich tożsamości, zostaną znalezione znane różnice między HI (G) i HI (AC). W hi (g) jest link H-i; Podczas gdy w HI (AC) są to w rzeczywistości para jonów i- i H3ALBO+ interakcja elektrostátycznie (obraz doskonały).
Z drugiej strony HI (AC) jest źródłem hi (g), ponieważ pierwszy jest przygotowywany przez rozpuszczenie drugiego w wodzie. Z tego powodu, chyba że jest w równaniu chemicznym, HI może być również użyte w odniesieniu do kwasu Iarchydric. HI jest silnym środkiem redukującym i doskonałym źródłem jonów i- W wodnym pożywce.
[TOC]
Struktura kwasu jodhydowego
Kwas jodhydowy, jak wyjaśniono, składa się z roztworu HI w wodzie. Będąc w wodzie, cząsteczki hi całkowicie się dysocjują (silny elektrolit), pochodząc z jonów i- i H3ALBO+. Dysocjacja to może być reprezentowana z następującym równaniem chemicznym:
Cześć (g) + h2Lub (l) => i-(AC) + H3ALBO+(AC)
Co byłoby równoważne, gdyby napisane jako:
Cześć (g) + h2Lub (l) => hi (ac)
Jednak HI (AC) wcale nie ujawnia, co stało się z gazowymi cząsteczkami HI; Wskazuje tylko, że są one w podwórzu wodnym.
Dlatego prawdziwa struktura HI (AC) składa się z jonów i- i H3ALBO+ otoczony cząsteczkami wody nawilżającymi; Im bardziej skoncentrowany kwas iarhydrałowy, tym niższa liczba cząsteczek wody bez protonu.
Może ci służyć: Boyle LawW rzeczywistości stężenie HI wynosi od 48 do 57% w wodzie; Bardziej skoncentrowane byłoby to, że kwas zbyt paliłby (i jeszcze bardziej niebezpieczny).
Na zdjęciu widać, że anion i- Jest reprezentowany z fioletową kulą i h3ALBO+ Z białymi kulami i czerwoną, dla atomu tlenu. Kation h3ALBO+ Przedstawia geometrię molekularną trygonalną piramidę (widoczną z wyższej płaszczyzny na obrazie).
Nieruchomości
Opis fizyczny
Bezbarwny płyn; Ale możesz wykazywać żółtawe i brązowe tony, jeśli jesteś w bezpośrednim kontakcie z tlenem. To dlatego, że jony i- W końcu utleniają jod molekularny, i2. Jeśli jest dużo ja2, Jest więcej niż prawdopodobne, że anion triaduro zostanie utworzony3-, który plami roztwór jako brązowy.
Masa cząsteczkowa
127,91 g/mol.
Zapach
Akr.
Gęstość
Gęstość wynosi 1,70 g/ml dla 57%roztworu HI; Ponieważ gęstości różnią się w zależności od różnych stężeń HI. Stężenie to tworzy azeotropowy (jest on destylowany jako pojedyncza substancja, a nie jako mieszanka), której względna stabilność może być winna jego komercjalizacja powyżej innych roztworów.
Punkt wrzenia
57% Hi Azeotrope gotuje się w temperaturze 127ºC pod ciśnieniem 1,03 bar (przejście do bankomatu).
PKA
-1,78.
Kwasowość
Jest to wyjątkowo silny kwas, tak bardzo, że jest żrący dla wszystkich metali i tkanek; Nawet dla gumy.
Wynika to z faktu, że łącze H-i jest bardzo słabe i jest łatwo złamane podczas jonizacji wody. Ponadto mosty wodorowe i- - Hoh2+ Są słabe, więc nie ma nic do zakłócenia H3ALBO+ reagować z innymi związkami; to znaczy h3ALBO+ ma „darmowe”, jak ja- To nie przyciąga zbyt wiele do jego przeciwmiona.
Może ci służyć: piknometrŚrodek redukujący
HI jest potężnym środkiem redukującym, którego głównym produktem reakcji jest ja2.
Nomenklatura
Nomenklatura kwasu iarhydralnego wywodzi się z faktu, że jod „działa” z jednym stanem utleniania: -1. A ponadto nazwa wskazuje, że ma wodę w swojej formule strukturalnej [i-] [H3ALBO+]. To jest jego jedyna nazwa, ponieważ nie jest to czysty związek, ale rozwiązanie.
Aplikacje
Źródło jodu w syntezie organicznej i nieorganicznej
HI jest doskonałym źródłem jonów i- do syntezy nieorganicznej i organicznej, a także jest silnym środkiem redukującym. Na przykład jego 57% rozpuszczanie wodne stosuje się do syntezy jodków alkilowych (takich jak CHO3Ch2I) z podstawowych alkoholi. Podobnie grupa OH może zastąpić w strukturze i.
Środek redukujący
Kwas jodhydowy zastosowano do zmniejszenia, na przykład, węglowodanów. Jeśli glukoza rozpuszczona w tym kwasie zostanie podgrzewana, straci wszystkie swoje grupy OH, uzyskując jako produkt n-heksan węglowodorów.
Podobnie zastosowano go do zmniejszenia funkcjonalnych grup arkuszy grafenu, aby można je było funkcjonalizować dla urządzeń elektronicznych.
Proces CATIVA
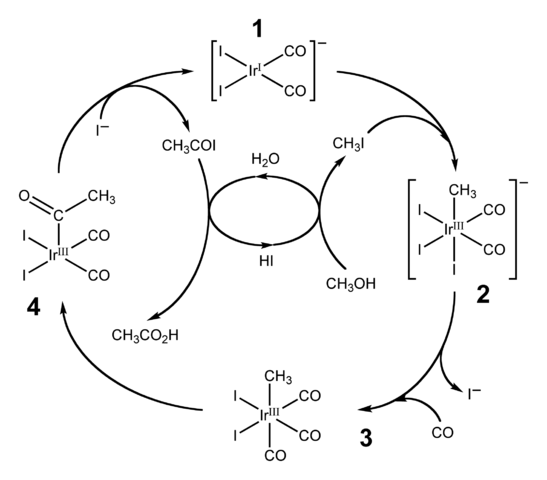 Schemat cyklu katalitycznego dla procesu CATIVA. Źródło: Ben Mills [domena domeny publicznej].HI jest również wykorzystywane do przemysłowej produkcji kwasu octowego poprzez proces CASIVA. Składa się z cyklu katalitycznego, w którym występuje karbonilacja metanolu; to znaczy do cząsteczki CH3OH Wprowadzono grupę karbonylową, C = O, aby przekształcić się w kwas Cho3Cooh.
Schemat cyklu katalitycznego dla procesu CATIVA. Źródło: Ben Mills [domena domeny publicznej].HI jest również wykorzystywane do przemysłowej produkcji kwasu octowego poprzez proces CASIVA. Składa się z cyklu katalitycznego, w którym występuje karbonilacja metanolu; to znaczy do cząsteczki CH3OH Wprowadzono grupę karbonylową, C = O, aby przekształcić się w kwas Cho3Cooh.
Kroki
Proces rozpoczyna się (1) od kompleksu organo-iridium [IR (CO)2Siema2]-, kwadratowej płaskiej geometrii. Ten związek „odbiera” jodek metylu, CH3Ja, produkt zakwaszenia cho3Och z 57% cześć. Woda występuje również w tej reakcji, a dzięki niej kwas octowy uzyskuje się na końcu, jednocześnie pozwalając HI na odzyskanie w ostatnim kroku.
Może ci służyć: koloidNa tym etapie zarówno grupa -ch3 Gdy -i dołącza do Ididio Metal Center (2), tworząc ośmiadralny kompleks z aspektem złożonym z trzech ligandów i. Jeden z Yodos zastępuje się cząsteczką tlenku węgla, CO; A teraz (3), ośmiadralny kompleks ma aspekt złożony z trzech Co -ligandów.
Następnie nastąpi zmiana: grupa -ch3 Jest „wydany” z IR i dołącza do sąsiedniego (4), tworząc grupę acetylową, -coch3. Ta grupa jest uwalniana z kompleksu Iridido, aby połączyć się z jonami jodku i dać Cho3COI, jodek acetylu. Tutaj odzyskuje się katalizator irydium, gotowy do udziału w innym cyklu katalitycznym.
Wreszcie Cho3COI cierpi na wymianę I- Dla cząsteczki H2Lub, którego mechanizm kończy się uwalnianiem HI i kwasu octowego.
Nielegalna synteza
 Reakcja redukcji efedryny z czerwonym fosforem i fosforem na metaptaminę. Źródło: Metamphetamine_from_ephedrine_with_hi_ru.SVG: pochodne Ring0 Trabajo: MaterialScientist (mówienie) [domena publiczna].Kwas jodhydowy został zastosowany do syntezy substancji psychotropowej, wykorzystując jej wysoką moc redukcyjną. Na przykład możesz zmniejszyć efedrynę (lek do leczenia astmy) w obecności czerwonego fosforu do metamfetaminy (obraz górny).
Reakcja redukcji efedryny z czerwonym fosforem i fosforem na metaptaminę. Źródło: Metamphetamine_from_ephedrine_with_hi_ru.SVG: pochodne Ring0 Trabajo: MaterialScientist (mówienie) [domena publiczna].Kwas jodhydowy został zastosowany do syntezy substancji psychotropowej, wykorzystując jej wysoką moc redukcyjną. Na przykład możesz zmniejszyć efedrynę (lek do leczenia astmy) w obecności czerwonego fosforu do metamfetaminy (obraz górny).
Można zauważyć, że zastąpienie grupy OH przez I, a następnie drugą wymianę H na H.
Bibliografia
- Wikipedia. (2019). Kwas wodny. Źródło: w:.Wikipedia.org
- Andrews, Natalie. (24 kwietnia 2017). Zastosowanie kwasu hydriodowego. Naukowe. Odzyskane z: naukowe.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Kwas hydriodowy. Odzyskane z: alfa.com
- National Center for Biotechnology Information. (2019). Kwas hydriodowy. Baza danych Pubchem., CID = 24841. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Steven a. Hardinger. (2017). Ilustrowany glosariusz chemii organicznej: kwas wodny. Odzyskane z: chem.UCLA.Edu
- Reusch William. (05 maja 2013). Węglowodany. Odzyskane z: 2.Chemia.MSU.Edu
- W Kyu Moon, Junghyun Lee, Rodney's. Ruoff i Hyoyoung Lee. (2010). Zamężony tlenek trapenu przez grafityzację chemiczną. Doi: 10.1038/NCOMMS1067.
- « Charakterystyka uczenia się, typy i przykłady
- Charakterystyka bioprocesyjna, typy, zalety i etapy »

