Struktura kwasu sulfámowego, właściwości, synteza,
- 1721
- 120
- Bertrand Zawadzki
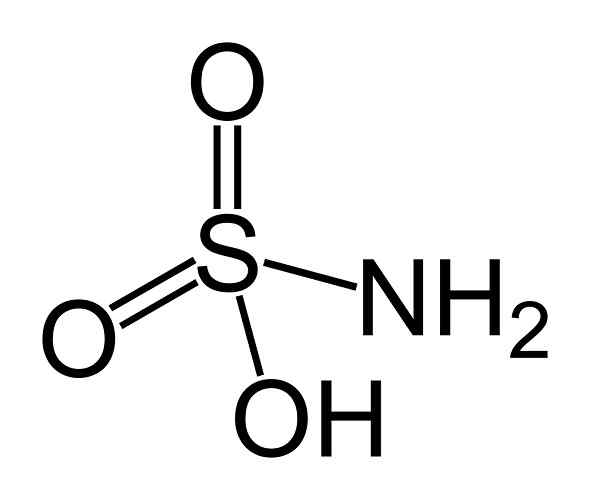
On kwas sulfamowy Jest to związek nieorganiczny utworzony przez atom siarki (S) przymocowany w postaci kowalencyjnej i prostym linkiem do grupy hydroksylowej (-OH) i grupy aminowej (-NH2) i przez podwójne wiązanie z dwoma atomami tlenu (O). Jest to biała krystaliczna substancja stała. Jego formuła chemiczna to NH2południowy zachód3H. Jest również znany jako kwas aminosulfonowy, kwas amidosulfonowy, kwas amidosulfurowy i kwas sulfamidowy.
Kwas sulfámowy jest silnym kwasem. Możesz reagować z metali, metali i tlenków węglanowych. Jego sole są ogólnie rozpuszczalne w wodzie, więc jest to dobry zmywacz wkładek w urządzeniach procesowych. Jest często stosowany w młynach cukrowych do czyszczenia inkrusterów węglanowych w parownikach.
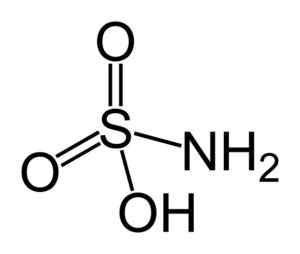 Struktura kwasu sulfámowego. Benjah-BMM27 [domena publiczna]. Źródło: Wikipedia Commons.
Struktura kwasu sulfámowego. Benjah-BMM27 [domena publiczna]. Źródło: Wikipedia Commons. Kwas sulfámowy jest redukcją azotynów (nie2-) i ta właściwość chemiczna jest stosowana w kilku zastosowaniach, jak w analizie przemysłu barwnika i azotynów.
Ma zastosowanie w skórzanym opalaniu i wybielaniu miazgi do produkcji papieru. W rzeczywistości jest to zanieczyszczenie żywności, ponieważ często występuje w dokumentach i kartach używanych do pakowania sklepów spożywczych.
Jest również stosowany w elektrodzie metalowej, jako wzór laboratoryjny, a jeden z jego pochodnych jest bardzo skuteczny herbicyd.
[TOC]
Struktura
Kwas sulfamowy krystalizuje w postaci dwupiramidalnych kryształów Ortorrumbus. Tworzyć zwarte pryzmaty i arkusze, gdy krystalizuje się z zimnego roztworu, a także arkusze romb.
Nomenklatura
- Kwas sulfamowy
- Kwas aminosulfonowy
- Aamidosulfonowy kwas
- Aamidosulfurowy kwas
- Sulfami -arne
Nieruchomości
Stan fizyczny
Biała krystaliczna stała.
Waga molekularna
97,1 g/mol.
Temperatura topnienia
205 ° C, rozkłada się na 209 ° C.
Gęstość
2,15 g/cm3
Rozpuszczalność
Rozpuszczalny w wodzie:
- 12,8% do 0 ºC
- 17,57% przy 20 ° C
- 22,77% w 40 ° C
Ledwo rozpuszczalne w metanolu, lekko rozpuszczalne w acetonie, nierozpuszczalne w eterze.
Swobodnie rozpuszczalne w podstawach azotu i rozpuszczalnikach organicznych zawierających azot.
Nierozpuszczalne w disiarczku węgla (CS2) i tetrachlorku węgla (CCL4).
Ph
0,41 (w roztworze 1 N, to znaczy 1 równoważny/L).
Stała dysocjacji
0,101 do 25 ºC.
Właściwości chemiczne
To silny kwas. Prawie tyle samo jak kwasy solne (HCl), azot3) i siarki (h2południowy zachód4).
Może ci służyć: natlenione związki: właściwości, reakcje, zastosowaniaWodne roztwory kwasu sulfamowego są wysoce zjonizowane. Jego pH jest niższe niż roztwory kwasów mrówkowych, fosforowych i szczawicznych.
W wodzie kwas sulfamowy traci tylko proton związany z tlenem. Hydrogeny z azotem pozostają mocno zjednoczone.
W roztworze wodnym powoli hydrolizuje się, aby podawać siarczan kwasu amonu (NH4Hso4). Jest stabilny w suchych warunkach.
Kwas sulfámowy atakuje metale, tlenki metali i węglany w celu wytwarzania sulfamatów. Na przykład z sulfaminianem potasu (k) potasu (koso2NH2) i wodór (h2).
Wszystkie sole kwasu sulfamowego są rozpuszczalne w wodzie. Sole wapnia, ołowiu i baru są bardzo rozpuszczalne w wodzie, w przeciwieństwie do odpowiedniego kwasu siarkowego.
Kwas azotu (hno2) reaguj ilościowo z grupą aminową kwasu sulfamowego, uwalniając azot (n2). Szacuje się, że jon sulfaminianowy działa w tej reakcji jako amida, a nie jako amina.
Kwas sulfámowy utlenia się przez chlor, brom lub chloran potasowy w celu przekształcenia go w kwas siarkowy. Ta reakcja nie występuje w przypadku innych utleniaczy, takich jak kwas chromowy lub permanganian potasu.
Nie jest kompatybilny (reaguje) z silną alkalis, chlorem, hipoklorystycznym kwasem, hipochlorytami, cyjankami i sulfidami.
Inne właściwości
Nie jest higroskopijny (oznacza to, że nie wchłania wilgoci powietrza).
Po podgrzaniu do rozkładu emituje wysoce toksyczne opary tlenków siarki i chlorku wodoru (HCl).
Jednym z jego pochodnych, sulfaminian amonu, jest opóźniaczem.
Jest umiarkowanie toksyczny.
Synteza
Kwas sulfámowy uzyskuje się przez reakcję mocznika (NH2)2 Z paleniem kwasu siarkowego, to znaczy kwas siarkowy (h2południowy zachód4) koncentrat zawierający trójtlenek siarki (więc3).
Można go również zsyntetyzować poprzez reakcję kwasu chlorosulfonowego (HCLO3Cl) i amoniak (NH3).
Aplikacje
W branży kolorowanki
Kwas sulfámowy służy do szybkiego i skutecznego usunięcia nadmiaru azotynów w reakcjach diazotyzacji w syntezie kolorowania. Jest to o wiele bardziej praktyczne niż mocznik w tym celu.
W przetwarzaniu skóry
Podczas opalania skórzanego użycie kwasu sulfamowego zamiast kwasu siarkowego zapewnia cieńszą i bardziej jedwabistą konsystencję.
Może ci służyć: metalowe minerałyPonadto, ponieważ sulfaminian wapnia jest rozpuszczalny w wodzie, w przeciwieństwie do siarczanu wapnia, kwas sulfámowy może być stosowany w rozczarowanym procesie bez pozostawienia plam, które czasami występują w skórze, gdy stosuje się kwas siarkowy.
 Skórzane obuwie. Źródło: Pixabay.
Skórzane obuwie. Źródło: Pixabay. W czyszczeniu urządzeń procesowych
Kwas sulfámowy jest stosowany jako środek do czyszczenia dekalcyfikatora w gotowaniach, reaktorach, rurach, systemach chłodzenia i wymiennikach ciepła.
W tych urządzeniach powstają inkrustowanie krążenia wody lub związków procesu w roślinach energetycznych, roślinach chemicznych, podejść, fabrykach papierowych, stacjach kompresyjnych i innych branżach.
Wkładki lub osady stałe mogą być organiczne (glony, muł, grzyby) lub nieorganiczne (tlenki żelaza, siarczki żelaza, węglany wapnia lub magnezu, siarczany, fosforany lub krzemiany).
Kwas sulfámowy jest bardzo skuteczny, gdy jest stosowany do wyeliminowania wkładek węglanowych wapnia. Może być stosowany w miedzianym wyposażeniu, mosiądzu, stali nierdzewnej, żeliwa i stali ocynkowanej.
Jest stosowany w roztworze 5-10% według wagi. Jest używany szczególnie w młynach cukrowych do czyszczenia parowników wykonanych z żeliwa z miedzianymi wymiennikami ciepła.
 Zespół parownika w młynie cukrowym. Autor: Antiksh Kumar. Źródło: Pixabay
Zespół parownika w młynie cukrowym. Autor: Antiksh Kumar. Źródło: Pixabay Powinien być stosowany w temperaturach nie większych niż 50-60 ° C. 70 ° C Temperatury prowadzą do tworzenia nierozpuszczalnych siarczanów, takich jak przypadek4.
W połączeniu z chlorkiem sodu występuje efekt synergii, a roztwór umożliwia powolne rozpuszczenie tlenku żelaza. W takim przypadku nie należy go stosować ze stali nierdzewnej, ponieważ uwalnia się kwas solny, co może powodować korozję w tym materiale.
W rafinacji metalu
Elektrodeporowanie metalu, takie jak miedź, srebro, kobalt, nikiel, cynk, kadm, żelazo i ołów, można z powodzeniem wykonać w roztworach kwasu sulfamowego. Można to obsługiwać znacznie łatwiejsze niż hydrofilalny kwas kwaśny (h2SIF6).
Jako odczynnik wzorca w laboratorium
Biorąc pod uwagę pewne cechy kwasu sulfamowego, takie jak: jego siła jako kwas, jego łatwość oczyszczania przez rekrystalizację w wodzie, jego stabilność i jego niehydroskopowość, został wykorzystany jako główny standard na poziomie laboratoryjnym. Oznacza to, że jest używany do ilościowych oznaczeń alkalicznych.
 Laboratorium. Publicdomainpictures. Źródło: Pixabay
Laboratorium. Publicdomainpictures. Źródło: Pixabay W analizie azotynów
Ze względu na łatwą reakcję z azotynami kwas sulfámowy stosuje się do oznaczania ich w roztworze.
Może ci służyć: kwas triclorooctowy: struktura, właściwości, synteza, zastosowania, efektyW analizie wody rozpuszczonej w wodzie
Ponieważ reagujący kwas sulfamowy z azotynami wody jest uwalniany azot, możliwe jest określenie rozpuszczonego tlenu w wodzie, ponieważ interferencja spowodowana przez azotyny jest eliminowana.
W przygotowaniu podtlenku azotu
Kwas sulfámowy reaguje z kwasem azotowym wytwarzającym podtlenek azotu (n2ALBO). Ta reakcja jest bezpieczniejsza niż azotan amonu w celu uzyskania wspomnianego gazu.
W rolnictwie
Pochodna kwasu sulfámowego, sulfaminian amonu, jest nietoksycznym herbicydem dla zwierząt.
Jest stosowany przez rosę na arkuszach gatunku, które mają zostać wyeliminowane pod koniec lata lub początkowe jesieni, najlepiej w wilgotnej pogodzie. Po przeniesieniu związku z liści do korzeni roślina umiera.
 Rocío Herbicyd. Autor: Zefe Wu. Źródło: Pixabay
Rocío Herbicyd. Autor: Zefe Wu. Źródło: Pixabay Kolejną zaletą tego związku jest to, że podłoże nie stałe sterylizuje. Rzeczywiście, niektóre azot sulfaminianowy amonu będzie dostępny na ziemi w celu wzrostu roślin w następnym sezonie.
W tkaninach ognioodpornych
Jego zgodność z celulozą i jej charakterystycznym opóźnieniem przeciwpożarowym przekształcanie sulfaminianu amonu w środek w celu uzyskania opornych na ogień tkanin i papieru.
Stosuje się 10% masy tkaniny, których wygląd i uczucie dotyku pozostają niezmienione. Tkanina, gdy jest w użyciu, powinna być umyta sucha, nigdy nie umywana wodą, aby nie rozpuścić się w sulfaminiatu.
Jest to przydatne, szczególnie w kinach lub podobnych miejscach.
 Teatr. Autor: Mustangjoe Źródło: Pixabay
Teatr. Autor: Mustangjoe Źródło: Pixabay W różnych aplikacjach
Jest stosowany jako katalizator w niektórych reakcjach chemicznych, jak w przygotowaniu żywic mocznika. Jest również przydatny jako bakteriobójstwo i stabilizator chloru w basenach oraz jako drewniany wybielacz miazgi w fabrykach miazgi i papieru.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Kwas sulfamowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov
- Williams, zm.L.H. (2004) Notozowanie w centrach azotu. W reakcjach nitozowania i chemii tlenku azotu. Rozdział 2. Odzyskane z naukowym.com
- Clapp, lealllyn b. (1943). Kwas sulfamowy i jego zastosowania. Chem. Edukacja. 1943, 20, 4, 189. Odzyskane z pubów.ACS.org
- McDonald, James. (2003). Kwas sulfamowy. Odzyskano z VeoliiaWaterTech.com
- Sastri, v.S. (2010). Zarządzanie i kontrola korozji. W korozji Shreira. Odzyskane z naukowym.com
- Bajpai Pratima. (2018). Różne tematy. W Podręczniku miazgi i papieru Biermanna. Trzecia edycja. Odzyskane z naukowym.com
- « Ostre dźwięki charakterystyki i przykłady
- Struktura wirusa monokatenowego, replikacja, znaczenie »

