Co jest disulfurowe, co jest struktura, właściwości, używa
- 3389
- 244
- Matylda Duda
Co to jest kwas dwusiarczowy?
On kwas disiulfurowy Jest to jeden z wielu oksoacidów siarki, których wzór chemiczny wynosi h2S2ALBO7. Wzór wyraźnie wskazuje, że istnieją dwa atomy siarki, a jak wskazuje jego nazwa, muszą istnieć dwie cząsteczki H2południowy zachód4 tylko jeden; Jednak istnieje siedem tlenu zamiast ośmiu, więc siarka musi mieć trzy.
Kwas ten jest jednym z głównych składników oleju (lub dymu kwasu siarkowego), który staje się „gęstym” kształtem kwasu siarkowego. Taka jest ich przewaga, którą niektórzy uważają olej za synonim kwasu disiulfurowego; który jest również znany pod tradycyjną nazwą kwasu pirozulfurowego.
Na obrazie pokazano biorcę z olejem, ze stężeniem tritlesu siarki, więc3, 20 %. Ta substancja charakteryzuje się tłustą i bezbarwną; chociaż żółtawy lub brązowy może stać się żółty w zależności od stężenia SO3 i obecność niektórych zanieczyszczeń.
Powyższe opowiada o uczestnictwie SO3 w h2S2ALBO7; to znaczy cząsteczka H2południowy zachód4 Reaguj z jednym z3 Tworząc kwas dwusiarczowy. Będąc wtedy, h2S2ALBO7 Można go również napisać jako h2południowy zachód4·POŁUDNIOWY ZACHÓD3.
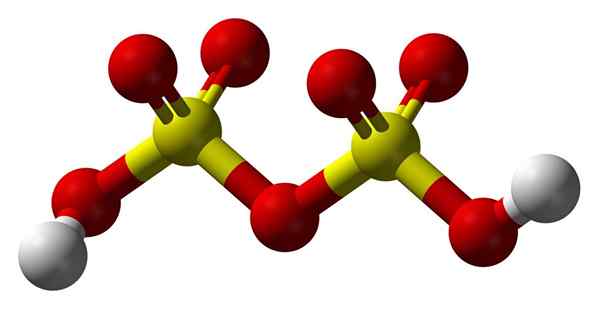
Struktura kwasu dwusiarczkowego
 Struktura kwasu dwusiarczowego
Struktura kwasu dwusiarczowego W górę2S2ALBO7 W modelu sfer i słupków. Zwróć uwagę na symetrię cząsteczki: lewa strona mostu tlenu jest identyczna z prawą. Z tej perspektywy struktura można opisać wraz z formułą HO3Mdłe3H.
Na obu końcach każda grupa hydroksylowa, której wodór, przez indukcyjne działanie wszystkich tych atomów tlenu, zwiększa jej dodatnie obciążenie częściowe; I w konsekwencji kwas dwusiarczowy ma jeszcze większą kwasowość niż kwas siarkowy.
Może ci służyć: wodorotlenek potasu: struktura, właściwości, zastosowaniaCząsteczkę można zapisać jako h2południowy zachód4·POŁUDNIOWY ZACHÓD3. Jednak odnosi się to bardziej do składu oleum niż do struktury cząsteczki.
Jeśli jednak cząsteczka wody zostanie dodana do H2S2ALBO7, Uwolnią się dwie cząsteczki H2południowy zachód4:
H2S2ALBO7 + H2Lub 2H2południowy zachód4
Równowaga może przesunąć się w lewo: do utworzenia H2S2ALBO7 Z h2południowy zachód4 Jeśli ciepło jest dostarczane. Z tego powodu Hor H2S2ALBO7 Jest również znany jako kwas pirozulfurowy; Ponieważ można go wytwarzać po ogrzewaniu kwasu siarkowego.
Także, jak wspomniano na początku, h2S2ALBO7 Jest tworzony przez bezpośrednią kombinację H2południowy zachód4 A więc3:
południowy zachód3 + H2południowy zachód4 H2S2ALBO7
Nieruchomości
 Oleum. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], przez Wikimedia Commons
Oleum. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], przez Wikimedia Commons Właściwości kwasu dwusiarczowego nie są zbyt dobrze zdefiniowane, ponieważ niezwykle trudno jest być izolowane wyłącznie z oleju.
Należy pamiętać, że w oleju mogą znajdować się inne związki2południowy zachód4· XSO3, gdzie w zależności od wartości x może nawet mieć struktury polimerowe.
Jednym ze sposobów wizualizacji jest wyobrażenie sobie, że górna struktura H2S2ALBO7 staje się bardziej wydłużony przez więcej jednostek3 i mosty tlenowe.
W prawie czystym stanie składa się z niestabilnego krystalicznego stałego (palenie), który topi się w 36ºC. Jednak ten punkt topnienia może się różnić w zależności od prawdziwego składu.
Kwas disiulfurowy może tworzyć tak zwane sole disiulfatów (lub piroziarczanu). Na przykład, jeśli reagujesz z wodorotlenkiem potasu, uformuj pitrosulfate potasu, k2S2ALBO7.
Ponadto można skomentować, że ma masę cząsteczkową 178 g/mol i dwa równoważne kwas+ które można zneutralizować za pomocą silnej podstawy).
Może ci służyć: ulatnianie sięReakcja odwodnienia cukru
Z tym związkiem w kształcie oleju można przeprowadzić ciekawą reakcję: transformacja guzków bloków węgla.
H2S2ALBO7 Reaguje z cukrami eliminującymi wszystkie swoje grupy OH w postaci wody, która sprzyja nowym związkom wśród atomów węgla; Związki, które ostatecznie powodują czarny węgiel.
Nomenklatura
Kwas dwusiarczowy jest uważany za bezwodnik kwasu siarkowego; Oznacza to, że traci cząsteczkę wody kondensacji między dwoma cząsteczkami kwasu. Przed tak wieloma możliwymi nazwami tego związku nomenklatura IUPAC po prostu zaleca, aby kwas dwusiarczkowy.
Termin „piro” nawiązuje wyłącznie do tego utworzonego jako produkt zastosowania ciepła. IUPAC nie doradza tej nazwy h2S2ALBO7; Ale jest obecnie używany przez wielu chemików.
Zakończenie -Co pozostaje niezmienne, ponieważ atom siarki nadal utrzymuje wartościowość +6. Na przykład można go obliczyć na następującym działaniu arytmetycznym:
2H + 2S + 7o = 0
2 (+1) + 2S + 7 (-2) = 0
S = 6
Aplikacje
Przechowuje kwas siarkowy
Kwas disiulfurowy, biorąc pod uwagę jego właściwość do zestalania się jako olej, jest w stanie rozpuszczać się i przechowywać bardziej bezpiecznie kwas siarkowy. To dlatego, że SO3 Ucieka tworząc nieodpowiednią „mgłę”, która jest znacznie bardziej rozpuszczalna w H2południowy zachód4 niż w wodzie. Aby uzyskać h2południowy zachód4, Wystarczy dodać do oleju wodnego:
H2S2ALBO7 + H2Lub 2H2południowy zachód4
100% synteza kwasu siarkowego
Z poprzedniego równania h2południowy zachód4 Jest rozcieńczony w dodanej wodzie. Na przykład, jeśli masz wodny roztwór H2południowy zachód4, Gdzie SO3 Ma tendencję do ucieczki i reprezentuje ryzyko dla pracowników, dodając olej do roztworu, reaguje to z wodą tworzącą więcej kwasu siarkowego; to znaczy zwiększenie jego stężenia.
Może ci służyć: nieprzenikniność chemicznaJeśli pozostanie jakaś woda, więcej jest dodawane3, który reaguje z h2południowy zachód4 wytwarzać więcej kwasu lub oleju dwusiarczowego, a następnie ponownie nawilża „suszenie” H2południowy zachód4. Proces powtarza czasem wystarczającym do uzyskania kwasu siarkowego w stężeniu 100%.
Podobny proces służy do uzyskania 100% kwasu azotowego. Podobnie zastosowano go do odwodnienia innych substancji chemicznych, stosowanych do opracowania wybuchowego.
Sulfonowanie
Struktury, takie jak barwniki; to znaczy, dodaj grupy -3H, który utrata kwasu może być zakotwiczona w polimerze włókien tekstylnych.
Z drugiej strony, kwasowość oleum jest używana do osiągnięcia drugiej nitrowania (dodaj grupy -NO2) do aromatycznych pierścieni.
Bibliografia
- Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- Kwas pirozpulowy. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov

