Struktura cykloheksanu, zastosowania, konformacje
- 2041
- 193
- Paweł Malinowski
On Cykloheksan Jest to stosunkowo stabilny cykl z wzorem molekularnym C6H12. Jest to bezbarwny i łatwopalny ciecz, który ma miękki zapach rozpuszczalnika, ale może to przenikać z zanieczyszczeń.
Ma gęstość 0,779 g/cm3; gotować w 80,7 ° C; i zamraża w 6,4 ° C. Jest uważany za nierozpuszczalny w wodzie, ponieważ jego rozpuszczalność może wynosić tylko 50 ppm (ok.) w temperaturze pokojowej. Jest jednak łatwo mieszany z alkoholem, eterem, chloroformem, benzenem i acetonem.
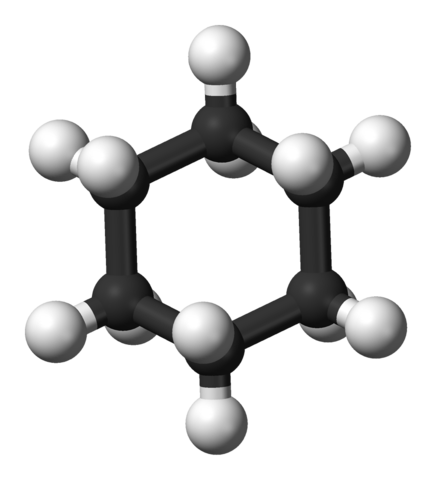
 Model 3D cząsteczki cykloheksanowej. Jynto i Ben Mills / Public Domena
Model 3D cząsteczki cykloheksanowej. Jynto i Ben Mills / Public Domena Systemy pierścieni cychaxan są bardziej powszechne wśród organicznych cząsteczek natury niż w innych cykloalcanosach. Może to wynikać zarówno z ich stabilności, jak i selektywności oferowanej przez jej dobrze ustalone konformacje.
W rzeczywistości węglowodany, sterydy, produkty roślinne, pestycydy i wiele innych ważnych związków zawierają pierścienie podobne do cykloheksanu, których konformacje mają ogromne znaczenie dla ich reaktywności.
[TOC]
Struktura
Cykloheksan to sześcio -licznikowy węglowodor alicykliczny. Istnieją głównie konformacja, w której wszystkie wiązania C-H w sąsiednich atomach węgla są zatoczone, z kątym dwuściennym równym 60 °.
Ponieważ ma najniższy kąt i napięcie skrętki. To sprawia, że cykloheksan.
Podstawy pozycji
Istnieją dwa rodzaje pozycji podstawników w pierścieniu cykloheksanu: pozycje osiowe i pozycje równikowe. Połączenia równikowe C-H znajdują się w zespole wokół Ekwadoru Pierścienia.
Z kolei każdy atom węgla ma osiowy wodór, który jest prostopadły do płaszczyzny pierścienia i równolegle do jego osi. Hydrogeny osiowe na przemian w górę i w dół; Każdy atom węglowy ma pozycję osiową i równikową; A każda strona pierścienia ma trzy pozycje osiowe i trzy równikowe w alternatywnym układzie.
Może ci służyć: węglan sodu (NA2CO3)Modele badawcze
Cykloheksan lepiej bada fizyczny model molekularny lub z programem modelowania molekularnego. Gdy używany jest którykolwiek z tych modeli, możliwe jest łatwe obserwowanie zależności skrętnych i orientacji równika i osiowego atomów wodoru.
Jednak rozmieszczenie atomów wodoru można również analizować w projekcji Newmana podczas obserwowania dowolnej pary równoległych łączy C-C.
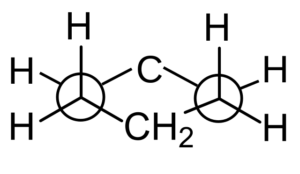 Projekcja Newmana z Cychaxan. Durfo / CC0
Projekcja Newmana z Cychaxan. Durfo / CC0 Konformacje
Cykloheksan może wystąpić w dwóch konformacjach, które można połączyć: łódź i krzesło. Jednak ta ostatnia jest najbardziej stabilną konformacją, ponieważ nie ma kąta ani napięcia skrętnego w strukturze cykloheksanu; Ponad 99% cząsteczek jest w konformacji krzesełkowej w danym momencie.
 Konformacja krzesła Cychaxan. Chem Sim 2001 / Public Domena
Konformacja krzesła Cychaxan. Chem Sim 2001 / Public Domena Konformacja krzesła
W konformacji krzesła wszystkie kąty łącza C-C wynoszą 109,5 °, co uwalnia je z napięcia kątowego. Ponieważ łącza C-C są doskonale rozłożone, konformacja krzesła jest również wolna od napięcia skrętnego. Ponadto atomy wodoru w przeciwnych zakątkach pierścienia cykloheksanu są oddzielone na maksimum.
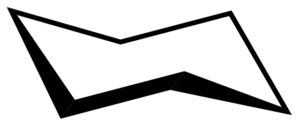
Formacja łodzi
Konformacja krzesła może przybierać inny kształt zwany formacją łodzi. Dzieje się tak w wyniku częściowych obrotów na prostych wiązaniach C-C pierścienia. Taka konformacja również nie ma napięcia kątowego, ale ma napięcie skrętne.
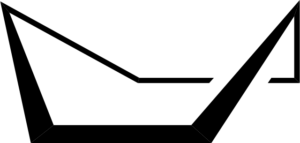 Cykloheksańska konformacja łodzi. Keministi / domena publiczna
Cykloheksańska konformacja łodzi. Keministi / domena publiczna Kiedy zobaczysz model konformacji łodzi, w osiach łącza C-C wzdłuż każdej strony, stwierdzono, że wiązania C-H w tych atomach węgla są zaćmienia, co powoduje napięcie skrętne.
Może ci służyć: pochodne benzenuPonadto dwa atomy wodoru są wystarczająco blisko siebie, aby wygenerować siły odpychania Van der Waalsa.
Oszust
Jeśli konformacja łodzi jest zgięta, uzyskuje się konformację krzywej łodzi, która może złagodzić część napięcia skrętnego, a także zmniejszyć interakcje między atomami wodoru.
Jednak stabilność uzyskana przez zgięcie jest niewystarczająca, aby konformacja krzywej łodzi była bardziej stabilna niż konformacja krzesła.
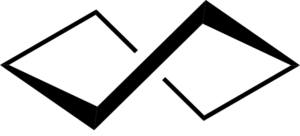 Cykloheksan konformacja łodzi. Keministi / CC0
Cykloheksan konformacja łodzi. Keministi / CC0 Aplikacje
Nylonowa produkcja
Prawie cały cykloheksan, który występuje w handlu (ponad 98%), jest szeroko stosowany jako surowiec w produkcji przemysłowej nylonowych prekursorów: kwas tłuszczowy (60%), kaprolaktam i heksametylendiamina. 75% kaprolaktamu produkowanego na całym świecie jest wykorzystywanych do produkcji nylonu 6.
 Gitara z nylonowymi linami. Źródło: Pexels.com
Gitara z nylonowymi linami. Źródło: Pexels.com Produkcja innych związków
Jednak cykloheksan jest również stosowany do produkcji benzenu, chlorku cykloheksylu, nitrocyloheksanu, cykloheksanolu i cykloheksanonu; w produkcji paliwa stałego; w preparatach grzybobójczych; oraz w przemysłowej rekrystalizacji sterydów.
Zastosowania mniejszościowe
Bardzo niewielka frakcja wytworzonego cyklu jest stosowana jako rozpuszczalnik nieolarny dla przemysłu chemicznego i rozcieńczającego w reakcjach polimerowych. Może być również używany jako zmywacza farby i lakieru; w ekstrakcji olejków eterycznych; i substytuty szkła.
Ze względu na unikalne właściwości chemiczne i konformacyjne cykloheksan jest również stosowany w analitycznych laboratoriach chemicznych do oznaczeń masy cząsteczkowej i jako standard.
Produkcja
Tradycyjny proces
Cykloheksan jest obecny w ropie naftowej w stężeniach, które różnią się między 0.1 i 1.0%. Dlatego kiedyś był tradycyjnie wytwarzany przez ułamkową destylację benzyny, w której 85% koncentratu cykloheksanu uzyskano przez superfloryzm.
Może ci służyć: atom węgla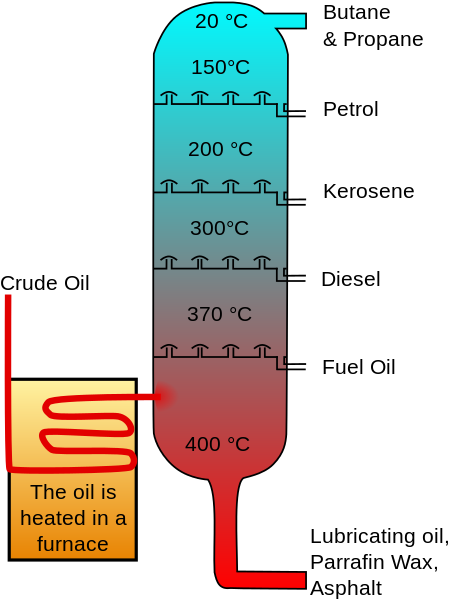 Frakcjonowana destylacja olejowa. Ropa_oil_distillation-fr.SVG: Image Original: Psaria, Theresa Knott; Image Vectorielle: Rogilberterivative Praca: UTAIN ()/CC BY-SA (http: // CreativeCommons.Org/licencje/by-sa/3.0/)
Frakcjonowana destylacja olejowa. Ropa_oil_distillation-fr.SVG: Image Original: Psaria, Theresa Knott; Image Vectorielle: Rogilberterivative Praca: UTAIN ()/CC BY-SA (http: // CreativeCommons.Org/licencje/by-sa/3.0/) Koncentrat ten został sprzedany, ponieważ dodatkowe oczyszczenie wymagane do przeprowadzenia procesu izomeryzacji pentanów, pęknięcia cieplne w celu wyeliminowania węglowodorów otwartego łańcucha i obróbki kwasu siarkowego w celu usunięcia związków aromatycznych.
Znaczna część trudności w uzyskaniu cykloheksanu z większą czystością była spowodowana dużą liczbą składników oleju z podobnymi punktami wrzenia.
Proces wysokiej wydajności
Obecnie cykloheksan występuje w skali przemysłowej poprzez reakcję benzenu z wodorem (katalityczne uwodornienie) ze względu na prostotę procesu i jego wysoką wydajność.
Reakcję tę można przeprowadzić metodami fazy ciekłej lub pary w obecności wysoce rozproszonego katalizatora lub w stałym łóżku katalitycznym. Opracowano kilka procesów, w których nikiel, platyna lub palade są wykorzystywane jako katalizator.
Większość roślin cykloheksanowych wykorzystuje gaz reformatorowy wytwarzany przez benzen i duże ilości wodoru według produktów jako surowca do produkcji cykloheksanu.
Ponieważ koszty wodoru i benzenu mają kluczowe znaczenie dla produkcji cykloheksanu w opłacalny sposób, rośliny zwykle znajdują się w pobliżu dużych rafinerii, w których dostępne są surowce o niskim poziomie.
Bibliografia
- Campbell, m. L. (2014). Cykloheksan. Encyklopedia chemii przemysłowej Ullmanna (7th wyd.). Nowy Jork: John Wiley & Sons.
- McMurry, J. (2011). Podstawy chemii organicznej (7th wyd.). Belmont: Brooks/Cole.
- National Center for Biotechnology Information. (2020) Baza danych PubChem. Cykloheksan, CID = 8078. Bethesda: National Library of Medicine. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Ouellette, r. J., & Rawn, j. D. (2014). Chemia organiczna - struktura, mechanizm i synteza. San Diego: Elsevier.
- Petrucci, r. H., Herring, f. G., Bissonnette, c., I dojrzałe, j. D. (2017). Chemia ogólna: zasady i nowoczesne zastosowania (11th wyd.). Nowy Jork: Pearson.
- Solomons, t. W., Fryhle, c. B., & Snyder, s. DO. (2016). Chemia organiczna (12th wyd.). Hoboken: John Wiley & Sons.
- Wade, l. G. (2013). Chemia organiczna (wydanie 8.). Nowy Jork. osoba.

