Właściwości rowerowe, reakcje, zastosowania, przykłady
- 1276
- 10
- Filip Augustyn
Cycloalcanos Są rodziną nasyconych węglowodorów o ogólnej wzorze CNH2n Co zbiega się z alkenami; z różnicą, że pozorne nienasycenie nie wynika z podwójnego wiązania, ale z pierścienia lub cyklu. Dlatego są uważane za izomery alquenos.
Powstają one, gdy alkan liniowe łączą końce ich łańcuchów, aby powstrzymać zamkniętą strukturę. Podobnie jak w przypadku alkanów, cykloalcan może wykazywać różne rozmiary, masy molekularne, podstawienia, a nawet układy złożone z więcej niż jednego pierścienia (policykliki).
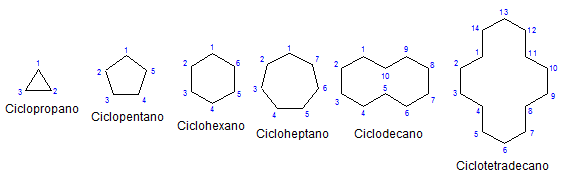
 Niektóre monocykliczne cykloalcanos. Źródło: Mephisto Spa przez Wikipedia.
Niektóre monocykliczne cykloalcanos. Źródło: Mephisto Spa przez Wikipedia. Reszty, chemia i fizycznie są podobne do alkanów. Mają tylko węgle i hydrogeny, są neutralnymi cząsteczkami i dlatego oddziałują przez siły ścian van der. Służą również jako paliwa, uwalniając ciepło, gdy płoną w obecności tlenu.
Dlaczego Cycloalcanos są bardziej niestabilne niż ich odpowiedniki otwartego łańcucha? Przyczynę można podejrzewać, obserwując przykłady cykloalcanów reprezentowane na górnym obrazie: istnieją napięcia i przeszkody steryczne (przestrzenne).
Zauważ, że im mniej węgle (wymienione na niebiesko), tym bardziej zamknięta jest konstrukcja; I odwrotnie dzieje się, gdy rosną, obracając się jak naszyjnik.
Małe cykloalcanos są gazowe, a gdy ich rozmiary zwiększają siły międzycząsteczkowe. W związku z tym mogą być płynne zdolne do rozpuszczenia tłuszczów i apolarnych, smaru lub ciał stałych, które wyglądają na ciemne kolory i cechy, takie jak kolory asfaltowe.
[TOC]
Fizyczne i chemiczne właściwości
Biegunowość
Gdy składa się tylko z węgli i hydrogenów, atomy, które nie różnią się zbytnio w elektroonegatywności, sprawia, że cząsteczki cykloalc.
Nie mogą oddziaływać poprzez siły dipol-dipolowe, ale zależą w szczególności od sił w Londynie, które są słabe, ale rosną wraz z masą cząsteczkową. Dlatego małe cykloalcanos (z mniej niż pięcioma węgliami) są gazowe.
Interakcje międzycząsteczkowe
Z drugiej strony, ponieważ są pierścieniami, Cycloalcanos mają większy obszar kontaktu, który faworyzuje siły w Londynie wśród ich cząsteczek. W ten sposób są grupowane i lepiej oddziałują w porównaniu z alkanami; A zatem jego punkty gotowania i fuzji są wyższe.
Ponadto, ponieważ mają dwa mniej atomów wodoru (cNH2n Dla Cycloalcanos i CNH2n+2 Dla alkanów) są lżejsze; I dodając do tego fakt jego największego obszaru kontaktowego, zmniejsza objętość zajmowaną przez jej cząsteczki, a zatem są one gęstsze.
Nasycenie
Dlaczego Cycloalcanos są klasyfikowane nasycone węglowodory? Ponieważ mają sposób, w jaki włączają cząsteczkę wodoru; Chyba że pierścień się otworzy, w takim przypadku stałyby się prostymi alkanami. Aby węglowodor został uznany za nasycony, musi mieć maksymalną możliwą liczbę łączy C-H.
Może ci służyć: potencjometr (fametr)Stabilność
Chemicznie są bardzo podobne do alkanów. Oba mają linki C-C i C-H, które nie są tak łatwe do złamania, aby wywołać inne produkty. Jednak ich względna stabilność różni się, co można weryfikować eksperymentalnie poprzez pomiar ich ciepła spalania (δHgrzebień).
Na przykład w porównaniu δHgrzebień W przypadku propanu i cyklopropo (reprezentowanego przez trójkąt na obrazie) jest odpowiednio 527,4 kcal/mol i 498,9 kcal/mol.
Szczegół jest taki, że cyklopropangrzebień niewielkie (471 kcal/mol), ponieważ są to trzy grupy metylenowe, CHO2; Ale w rzeczywistości uwalnia więcej ciepła, odzwierciedlając niestabilność większą niż oszacowane. Ta nadmiar energii mówi się, że jest to spowodowane napięciami wewnątrz ringu.
I w rzeczywistości napięcia te rządzą i różnicują reaktywność lub stabilność cykloalcanów, w odniesieniu do alkanów, w stosunku do konkretnych reakcji. Tak długo, jak napięcia nie są bardzo wysokie, cykloalkany są zwykle bardziej stabilne niż ich odpowiednie wierzchołki.
Nomenklatura
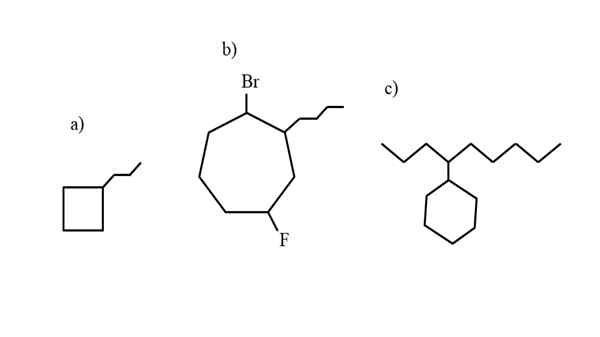 Niektóre przykłady podstawionego cykloalcanu w celu przetestowania zasad nomenklatury. Źródło: Gabriel Bolívar.
Niektóre przykłady podstawionego cykloalcanu w celu przetestowania zasad nomenklatury. Źródło: Gabriel Bolívar. Nomenklatura rządzona przez IUPAC dla Cycloalcanos nie różni się zbyt duża niż alkan. Najprostszą zasadą jest umieszczenie prefiks.
Zatem na przykład n-heksanu, cho3Ch2Ch2Ch2Ch2Ch3, Cykloheksan jest uzyskiwany (reprezentowany przez sześciokąt na pierwszym zdjęciu). W ten sam sposób, w jaki dzieje się tak z cyklopropanem, cyklobutanem itp.
Teraz związki te mogą cierpieć podstawień z jednego z ich hydrogenów. Gdy liczba węgli pierścienia jest wyższa niż w przypadku podstawników wynajmu, pierścień jest traktowany jako główny łańcuch; Tak jest A) dla obrazu doskonałego.
Zauważ, że w A) cyklobutan (kwadrat) ma więcej węgli niż powiązana z nim grupa propilus; Następnie ten związek jest nazywany propylcyklobutano.
Jeśli istnieje więcej niż jeden podstawnik, powinien zostać wymieniony w kolejności alfabetycznej i w taki sposób, że mają najmniej możliwy numer lokalizatora. Na przykład b) nazywa się: 1-bromo-4-fluoro-2-butilcicloheptano (a nie 1-bromo-5-fluoro-7-butylcicloheptano, co byłoby nieprawidłowe).
I wreszcie, gdy podstawnik alquiliczny ma więcej węgli niż pierścień, mówi się wtedy, że ta ostatnia jest grupą zastępczą głównego łańcucha. Zatem c) nazywa się: 4-cyclohexilnonano.
Może ci podać: tlenki metaluStruktura
Pomijając zastępowane cykle, wygodne jest skupienie się tylko na ich podstawach strukturalnych: pierścienie. Były one reprezentowane na pierwszym obrazie.
Podczas ich obserwowania może powstać fałszywa idea, że takie cząsteczki są płaskie; Ale z wyjątkiem Cyclopropo, jego powierzchnie są „zygzagenanty”, z węgliami spadającymi lub przesyłaniami w stosunku do tej samej płaszczyzny.
Dzieje się tak, ponieważ rozpoczęcie wszystkich węgli ma hybrydyzację SP3, i dlatego występują geometrie czworościenne z kątami łącza 109,5º. Ale jeśli geometria pierścieni jest starannie obserwowana, nie można ich być; Na przykład kąty w trójkącie cyklopropanowym wynoszą 60º.
To jest znane jako napięcie kątowe. Im większe pierścienie, kąt między łączami C-C jest bliższy 109,5º, co powoduje spadek takiego napięcia i wzrost stabilności dla cykloalkanu.
Inny przykład jest obserwowany w cyklobutanie, którego kąty łącza wynoszą 90º. Już w cyklopentano jego kąty wynoszą 108º, a z cykloheksanu mówi się następnie, że napięcie kątowe ustaje, aby wywierać taki efekt uwagi.
Konformacje
Oprócz napięcia kątowego istnieją inne czynniki, które przyczyniają się do napięcia doświadczanego przez Cycloalcanos.
Linki C-C nie mogą się obracać bez więcej, ponieważ oznaczałoby to, że cała struktura „dreszcz”. Zatem cząsteczki te mogą przyjmować bardzo dobrze zdefiniowane konformacje przestrzenne. Celem tych ruchów jest zmniejszenie napięć spowodowanych zaćmieniem atomów wodoru; to znaczy, gdy jeden przed drugim.
Na przykład konformacje dla cyklobutanu przypominają motyl, który bije jego skrzydła; te z cyklopentano, koperty; Te z cykloheksanu, łodzi lub krzesła i większego pierścienia, tym większa liczba i kształty mogą przyjąć w kosmosie.
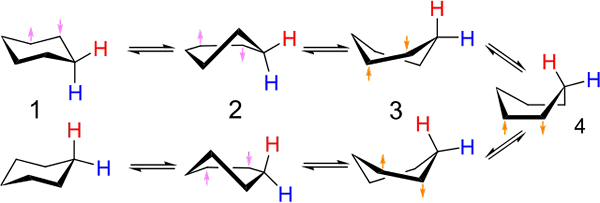 Inwestycje między przewodniczącym a konformacją typu łodzi dla cykloheksanu. Źródło: Kministi [CC0].
Inwestycje między przewodniczącym a konformacją typu łodzi dla cykloheksanu. Źródło: Kministi [CC0]. Najwyższy obraz pokazuje przykład takich konformacji dla cykloheksanu. Zauważ, że domniemany płaski sześciokąt wydaje się bardziej jak krzesło (po lewej stronie obrazu) lub łódź (po prawej). Wodór jest reprezentowany czerwonymi tekstami, a inny z niebieskimi tekstami, aby wskazać, jak zmieniają się ich względne pozycje po inwestycjach.
W (1), gdy wodór jest prostopadły do płaszczyzny pierścieniowej, mówi się, że jest w pozycji osiowej; A kiedy jest to równolegle, mówi się, że jest w pozycji równikowej.
Reakcje
Reakcje, które może cierpieć Cycloalcan, są takie same jak w przypadku alkanów. Oba płoną w obecności nadmiaru tlenu w typowych reakcjach spalania w celu wytworzenia dwutlenku węgla i wody. Podobnie oba mogą cierpieć halogenacje, w których wodór zastępuje atom halogenowy (F, Cl, Br, I).
Może ci służyć: zalety i wady chemii zdrowia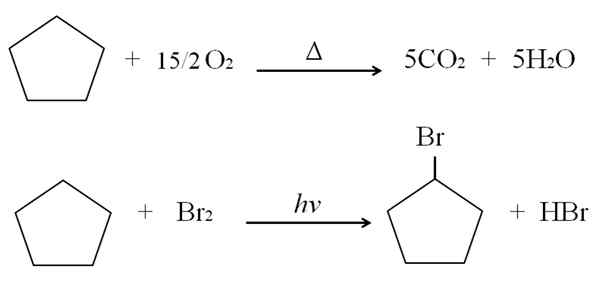 Reakcje cyklopentano. Źródło: Gabriel Bolívar.
Reakcje cyklopentano. Źródło: Gabriel Bolívar. Powyżej reakcji spalania i halogenowania dla cyklopentano pokazano jako przykład. Jeden kret płoną w obecności ciepła i 7,5 moli tlenu cząsteczkowego, aby podzielić się na co2 i H2ALBO. Z drugiej strony, w obecności ultrafioletu i bromu.
Aplikacje
Zastosowanie cykloalcanos zależy w dużej mierze od ich liczby węgli. Najlżejszy, a zatem gazowy, kiedyś służył do karmienia lamp gazowych świateł publicznych.
Tymczasem ciecze mają zyski jako rozpuszczalniki olejów, tłuszczów lub produkty komercyjne o charakterze apolarnym. Wśród nich możesz wspomnieć o cyklopentano, cykloheksanie i cykloheptanie. Podobnie są często używane w rutynowych operacjach w laboratoriach Petróleos lub w formulacji paliwowej.
Jeśli są cięższe, mogą być stosowane jako smar. Z drugiej strony mogą również reprezentować materiał początkowy dla syntezy leków; Podobnie jak karboplatyna, która obejmuje w swojej strukturze pierścień cyklobutanu.
Przykłady Cychannel
Wreszcie, jest zwracany na początek artykułu: obraz z kilkoma niezmienionymi cykloalcanos.
Aby zapamiętać cykloalcanos, wystarczy myśleć o geometrycznych postaciach: trójkąt (cyklopropan), kwadrat (cyklobutan), Pentagon (Cyclopentano), sześciokąt.
Im większy pierścień, tym mniej przypomina odpowiednią liczbę geometryczną. Widziano już, że cykloheksan jest wszystkim oprócz sześciokąta; To samo dzieje się bardziej ewidentnie z CyclooteTradecano (czternaście węgli).
Przychodzi punkt, w którym będą się zachowywać jak naszyjniki, które można złożyć w celu zmniejszenia napięć ich linków i zaćmień w pełni.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Chemia librettexts. (2 czerwca 2019). Nazywanie cykloalkanes. Odzyskane z: chem.Librettexts.org
- Wikipedia. (2019). Cykloalkane. Źródło: w:.Wikipedia.org
- Clark Jim. (2015). Przedstawiamy alkai i cykloalkany. Odzyskane z: chemguide.współ.Wielka Brytania
- James Ashenhurst. (2019). Konformacje i cykloalty. Master Organic Chemistry. Odzyskane z: MastorganicChemistry.com
- Fernández Germán. (S.F.). Cycloalcanos-Toria. Chemia organiczna. Odzyskane z: Chemicicaorganica.org

