Caspasas, co są, struktura, typy, funkcje
- 5036
- 1641
- Maksymilian Kępa
Jakie są kaspazy?
Caspasas Są to białka efektorowe zaprogramowanej śmierci komórki lub trasy apoptozy. Należą do rodziny zależnych od płaszcza i wysoce zachowanych proteazów specynujących asparia.
Używają reszty cysteiny w swoim miejscu aktywnym jako katalityczny nukleofil.
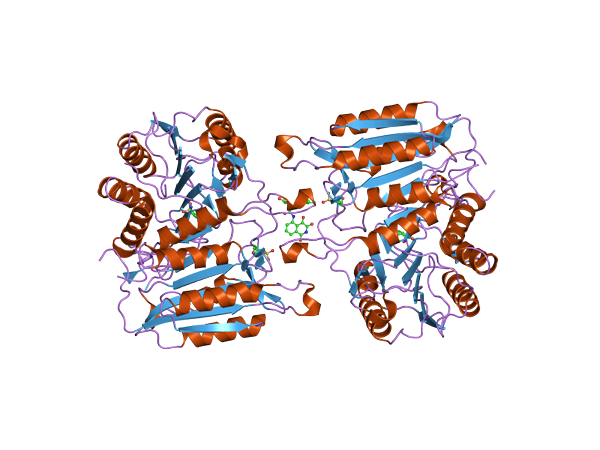
 Struktura Caspasa-3 (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [Public Domena] za pośrednictwem Wikimedia Commons)
Struktura Caspasa-3 (źródło: Jawahar Swaminathan i MSD pracownicy European Bioinformatics Institute [Public Domena] za pośrednictwem Wikimedia Commons) Apoptoza jest bardzo ważnym wydarzeniem w organizmach wielokomórkowych, ponieważ pełni ważną rolę w utrzymaniu homeostazy i integralności tkanek.
Rola capspass w apoptozie przyczynia się do krytycznych procesów homeostazy i naprawy, a także do Claive.
Te enzymy zostały opisane po raz pierwszy C. Elegans a następnie znaleziono powiązane geny u ssaków, gdzie ich funkcje ustalono poprzez różne podejścia genetyczne i biochemiczne.
Struktura Caspasas
Każda aktywna kaspaza wywodzi się z przetwarzania i samoocenacji dwóch prekursorów Zimogenas. Te prekursory to cząsteczki trójstronne o „śpiącej” aktywności katalitycznej i masy cząsteczkowej w zakresie od 32 do 55 kDa.
Trzy regiony są znane jako P20 (wielka wewnętrzna domena centralna 17-21 kDa i zawierająca aktywne miejsce podjednostki katalitycznej), P10 (domena C-końcowa 10-13 kDa znana również jako mała katalityczna podjednostka) i domena DD (DD (DD (DD Domena śmierci, 3-24 kDa, zlokalizowana na końcu N-końcowym).
W niektórych pro-mapujących domeny P20 i P10 są oddzielone przez małą sekwencję odstępów. Śmierć śmierci lub DDS na końcu N-końcowym ma 80-100 odpadów, które stanowią motywy strukturalne nadrodziny zaangażowanych w transdukcję sygnałów apoptotycznych.
Może ci służyć: klasyfikacja woese (3 system domeny)Domena DD z kolei jest podzielona na dwa subdominium: efekt śmierci efektorowej (DED) i domeny kaspasów rekrutują inne białka przez interakcje elektrostatyczne lub hydrofobowe.
Caspasses mają wiele zachowanych odpadów odpowiedzialnych za ogólne ustanowienie struktury i jej interakcji ligandu podczas montażu i przetwarzania Zimogenos, a także na inne białka regulacyjne.
Pro-Caspasas 8 i 10 mają dwie domeny. Pro-Casasas 1, 2, 4, 5, 9, 11 i 12 mają domenę karty. Obie domeny są odpowiedzialne za rekrut.
Aktywacja
Każde pro-mapowanie jest aktywowane przez odpowiedź na określone sygnały i selektywne przetwarzanie proteolityczne w określonych odpadach kwasu asparaginowego. Przetwarzanie kończy się tworzeniem homodimerycznych proteaz, które inicjują proces apaptotyczny.
Kaspazy inicjatora są aktywowane przez dimeryzację, podczas gdy efektory są aktywowane przez humornation. Istnieją dwie trasy aktywacji kaspaz; Zewnętrzny i wewnętrzny.
Trasa zewnętrzna lub droga receptora śmierci, implikuje uczestnictwo kompleksu sygnalizacyjnego śmierci jako kompleksu aktywatora dla pro-kapitalnych 8 i 10 i 10.
Trasa wewnętrzna lub trasa za pośrednictwem mitochondriów używa apoptosomu jako kompleksu aktywatora dla pro-kapitalnych 9.
Rodzaje kaspaz
Ssaki mają około 15 różnych cappów, od tej samej rodziny genetycznej. Ta nadrodzina obejmuje inne podrodziny, które są podzielone.
Może ci służyć: flora i fauna de mysiones (Argentyna)Zazwyczaj znane są 3 podklasy kaspaz u ssaków:
1-infapalny lub grupa I: Caspasas z dużymi profesjonalistami (Caspasa-1, Caspasa-4, Caspasa-5, Caspasa-12, Caspasa-13 i Caspasa-14), które odgrywają fundamentalną rolę w dojrzewaniu cytokin i in. reakcja zapalna.
2-Casepasas inicjatorzy apoptozy lub grupa II: Mają długą proc i caspasa-9)
3-efektywne lub grupa III: Mają krótkie protony (20-30 aminokwasów).
Funkcje Caspasas
Większość funkcji poszczególnych Casimas została wyjaśniona przez eksperymenty genetycznego wyciszania lub uzyskiwania mutantów, ustanawiając poszczególne funkcje dla każdego.
Funkcje apoptotyczne
Chociaż istnieją apoptotyczne drogi niezależne od kaspaz, enzymy te są krytyką wielu zaprogramowanych zdarzeń śmierci komórkowej, niezbędnych do prawidłowego rozwoju dużej części systemów organizmów wielokomórkowych.
W procesach apoptotycznych kaspazy inicjatyw są dyszami.
Jego specyficzny cel wewnątrzkomórkowy.
Funkcje nieapoptotyczne
Kaspas nie tylko wypełnia apaptotyczną rolę w komórce, ponieważ aktywacja niektórych z tych enzymów została wykazana przy braku procesów śmierci komórkowej. Jego nieapopotyczna rola implikuje funkcje proteolityczne i nie -proproteolityczne.
Uczestniczą w proteolitycznym przetwarzaniu enzymów w celu uniknięcia demontażu komórek; Wśród jego białych są białka takie jak cytokiny, kinazy, czynniki transkrypcyjne i polimerazy.
Może ci służyć: ArtiodactileFunkcje te są możliwe dzięki potranslacyjnym przetwarzaniu pro-kapitalnego lub ich proteolitycznego celu.
Funkcja immunologiczna
Niektóre kaspazy biorą udział w przetwarzaniu ważnych czynników w układzie odpornościowym, tak w przypadku Caspasa-1, który przetwarza pro-interterleucynę-1β z utworzeniem dojrzałego IL-1β, który jest kluczowym mediatorem odpowiedzi zapalnej.
Caspasa-1 jest również odpowiedzialny za przetwarzanie innych interleukin, takich jak IL-18 i IL-33, które uczestniczą w odpowiedzi zapalnej i wrodzonej odpowiedzi immunologicznej.
W proliferacji komórek
Pod wieloma względami kaspazy biorą udział w proliferacji komórek, szczególnie w limfocytach i innych komórkach układu odpornościowego, będąc kaspazą-8 jednym z najważniejszych zaangażowanych enzymów.
Wydaje się, że caspasa-3 ma również funkcje w regulacji cyklu komórkowego, ponieważ jest on zdolny do przetworzenia inhibitora kinazy w zależności od cyklin (CDK) P27, co przyczynia się do postępu indukcji cyklu komórkowego.
Inne funkcje
Niektóre kaspazy uczestniczą w postępie różnicowania komórek, zwłaszcza komórek, które wchodzą w stan postmmitotyczny, który jest czasem uważany za niepełny proces apoptozy.
Caspasa-3 ma kluczowe znaczenie dla odpowiedniego zróżnicowania komórek mięśniowych i innych czapek również uczestniczą w różnicowaniu szpiku, monocytów i erytrocytów.
Bibliografia
- Chowdhury, i., Tharakan, ur., & Bhat, g. K. (2008). CasPasses - aktualizacja. Biochemia porównawcza i fizjologia, część B, 151, 10-27.
- Degterev, a., Boyce, m., & Yuan, j. (2003). Dekada kaspaz. Oncogene, 22, 8543-8567.

