Struktura węglanu cynku (ZNCO3), właściwości, wykorzystuje

- 1316
- 80
- Estera Wojtkowiak
On węglan cynku Jest to związek nieorganiczny utworzony przez elementy cynku (Zn), węgiel (C) i tlen (O) (O). Jego formuła chemiczna to Znco3. Cynk ma stan utleniania +2, węgla +4 i tlenu -2.
Jest to bezbarwna lub biała substancja stała, która znajduje się w naturze, tworząc minerał Smithsonite, w którym może być sam lub z innymi elementami, takimi jak kobalt lub miedź, które nadają odpowiednio fioletowe lub zielone zabarwienie.
 Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/cc by-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/cc by-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Znco3 Jest prawie nierozpuszczalny w wodzie, ale łatwo rozpuszcza się w rozcieńczonych kwasach, jako jon węglanowy w kwaśnym kształcie węglowym (h2WSPÓŁ3), który następnie staje się gazem2 i woda.
Jest stosowany jako antyseptyczny w ranach zwierząt i czasami jest dostarczany w diecie, aby uniknąć chorób spowodowanych niedoborem cynku.
Służy do opóźnienia spalonych, że niektóre włókna, tworzywa sztuczne i dziąsła, gdy mają kontakt z ogniem. Pozwala bezpiecznie oddzielić toksyczne minerały arsenowe od innych skał.
Został użyty w pastach zębowych do odzyskania zębiny w zębach podczas wybielania.
[TOC]
Struktura
Znco3 Jest tworzony przez kation Zn2+ i Anion Co32-. Węgiel w jonie węglanowym ma stan utleniania +4. Ten jon ma płaską strukturę z trzema atomami tlenu otaczającymi atom węgla.
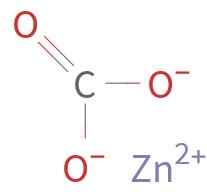 Struktura chemiczna węglanu cynku. Nieznany autor / domena publiczna. Źródło: Wikimedia Commons.
Struktura chemiczna węglanu cynku. Nieznany autor / domena publiczna. Źródło: Wikimedia Commons. Nomenklatura
- Węglan cynku
- Monokarbon cynku
- Kwas węglowy sól cynku
- Smithsonita
- Spat cynku
Nieruchomości
Stan fizyczny
Bezbarwne stałe lub krystaliczne białe. Kryształy rombowe.
 Węglan cynku. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons.
Węglan cynku. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons. Waga molekularna
125,4 g/mol
Temperatura topnienia
W 140 ° C rozpada się bez topnienia.
Gęstość
4 398 g/cm3 w 20 ° C.
Rozpuszczalność
Praktycznie nierozpuszczalny w wodzie: 0,000091 g/100 g H2Lub w 20 ° C. Rozpuszczalne w rozcieńczonych kwasach, sole alkalis i amonowych. Nierozpuszczalne w amoniaku, alkoholu i acetonie.
Właściwości chemiczne
Reaguje z kwasami tworzącymi dwutlenek węgla:
Znco3 + 2 godz+ → Zn2+ + H2Lub + co2↑
Rozpuszcza się w podstawach tworzących wodorotlenek, który jest częściowo rozpuszczony, tworząc jon cyncato:
Może ci służyć: brom: historia, struktura, konfiguracja elektroniczna, właściwości, użyciaZnco3 + 2 Och- → Zn (OH)2 + WSPÓŁ32-
Zn (OH)2 + H2Lub + OH- → [Zn (OH)3(H2ALBO)]-
To nie jest łatwopalne. Po podgrzaniu do jego rozkładu wytwarza tlenek cynku i dwutlenek węgla, ale może emitować tlenk węgla (CO).
Znco3 + ciepło → ZnO + CO2↑
Uzyskanie
Minerał Smithsonite jest uzyskiwany, wcześniej nazywany splot cynku.
Można go również przygotować przez zmieszanie roztworu węglanu sodu z solą cynkową, taką jak siarczan cynku. Siarczan sodu pozostaje rozpuszczony, a węglan cynku wytrąca się:
Znso4 + Na2WSPÓŁ3 → Znco3↓ + na2południowy zachód4
Aplikacje
W zabiegach medycznych
Ten związek pozwala uzyskać niektóre produkty farmaceutyczne. Jest stosowany do zapalonej skóry w postaci pyłu lub balsamu.
W aplikacjach weterynaryjnych
Znco3 Służy jako ściągający, antyseptyczny i miejscowy obrońca zwierząt u zwierząt.
Pozwala również na zapobieganie chorobom spowodowanym niedoborem cynku, dlatego jest stosowany jako suplement w diecie niektórych zwierząt, pod warunkiem, że podawane ilości znajdują się w normach ustalonych przez agencje zdrowotne.
 Węglan cynku jest czasami podawany jako mikroelement w celu uniknięcia chorób u świń. Nieznany autor / CC0. Źródło: Wikimedia Commons.
Węglan cynku jest czasami podawany jako mikroelement w celu uniknięcia chorób u świń. Nieznany autor / CC0. Źródło: Wikimedia Commons. W ogniskach weratozy u świń dodaje się do ich diety. Ta choroba jest zmianą skóry, w której warstwa rogówki nie jest odpowiednio uformowana.
Jako płomień opóźniający
Jest używany jako ognioodporne wypełnienie gumy i tworzyw sztucznych, które są narażone na wysokie temperatury. Pozwala chronić włókna tekstylne przed ogniem.
W przypadku bawełnianych tekstyliów nakładana jest do tkaniny wraz z niektórymi alkaliami. To bezpośrednio atakuje pierwotne grupy hydroksylowe (-ch2Och) celulozy i czyni je sodiocelulozą (-ch2NA).
Zerwanie połączeń celulozowych przez alkaliczne sprzyja większej penetracji łańcuchów zwartej struktury celulozowej, tak że większa ilość Znco3 udaje się wejść do strefy tego, a jej dyspersja jest ułatwiona.
Może ci służyć: wanad: historia, właściwości, struktura, użycia Niektóre bawełniane tkaniny mogą zawierać Znco3 we włóknach, aby były odporne na ogień. Socken_farbig.JPEG: Scott Bauerererivative Praca: Sock / Public Domena. Źródło: Wikimedia Commons.
Niektóre bawełniane tkaniny mogą zawierać Znco3 we włóknach, aby były odporne na ogień. Socken_farbig.JPEG: Scott Bauerererivative Praca: Sock / Public Domena. Źródło: Wikimedia Commons. W wyniku tego ilość łatwopalnego gazu, który mógłby wystąpić wraz z pożarem, jest zmniejszona.
W zabiegach dentystycznych
Niektóre kremy zębowe oparte na nanokryształach węglanowych cynku i hydroksyapatycie stosowane regularnie do protezy zmniejszają nadwrażliwość bardziej skutecznie niż te oparte na fluorku.
Nanokryształy Znco3 a hydroksiapatyt ma rozmiar, kształt, skład chemiczny i krystaliczność podobne do zębiny, dzięki czemu kanaliki zębowe można zamknąć przy zastosowaniu tych materiałów.
 Nanocząstki ZNCO3-Hydroksyiapatyt został pomyślnie przetestowany w celu zmniejszenia czułości w wybielonych zębach. Autor: Photo Mix. Źródło: Pixabay.
Nanocząstki ZNCO3-Hydroksyiapatyt został pomyślnie przetestowany w celu zmniejszenia czułości w wybielonych zębach. Autor: Photo Mix. Źródło: Pixabay. Ten rodzaj past dentifrycznych był przydatny po procesach wybielania zębów.
Oddzielić niebezpieczne minerały arsenowe
Arsenowe metody mineralne skał siarkowych (takich jak galena, chalkopiryt i piryt) zostały przetestowane przy użyciu ZNCO)3. Ruda w arsenu musi być oddzielona od innych, ponieważ ten element jest bardzo toksyczny i trujący zanieczyszczenie dla żywych istot.
Aby to osiągnąć, mieszaninę skał mielonych jest traktowana roztworem siarczanu cynku i węglanem sodu do pH 7,5-9,0 i związkiem xantate.
 Arsenopirita. Ten minerał powinien być oddzielony od innych, ponieważ zawiera toksyczny arsen. Separacja można osiągnąć za pomocą węglanu cynku. James St. John/cc przez (https: // creativeCommons.Org/licencje/według/2.0). Źródło: Wikimedia Commons.
Arsenopirita. Ten minerał powinien być oddzielony od innych, ponieważ zawiera toksyczny arsen. Separacja można osiągnąć za pomocą węglanu cynku. James St. John/cc przez (https: // creativeCommons.Org/licencje/według/2.0). Źródło: Wikimedia Commons. Skuteczność wzoru jest przypisywana tworzeniu się małych cząstek ZNCO3 Na powierzchni arsenopirytu, co czyni go hydrofilowym (związanym z wodą), więc nie można przestrzegać pęcherzyków powietrza i nie można pływać, wytrącać się i oddzielając od innych minerałów.
Otrzymując inne związki cynku
Węglan cynku zastosowano do uzyskania hydrofobowych nanostruktur boranu o wzorze 3ZNO • 3B2ALBO3• 3,5H2ALBO. Materiał ten może być używany jako dodatek opóźniający płomień w polimerach, drewnie i tekstyliach.
W odzyskiwaniu cynku pozostałych ścieków
Bogate syntetyczne wody na jony cynku odrzucone przez procesy elektrodkładania można leczyć za pomocą technologii złoża fluidalnego przy użyciu węglanu sodu w celu wytrącania ZNCO3.
Może ci służyć: alkohol wtórny: co to jest, struktura, właściwości, użyciaKiedy Zn wytrąca się2+ W postaci węglanu zmniejsza jego stężenie, uzyskana stała jest filtrowana, a wody można bezpiecznie odrzucić. Znco3 osad jest wysoką czystością.
Inne aplikacje
Pozwala na przygotowanie innych związków cynku. Jest używany w kosmetykach. Służy jako pigment i jest stosowany w produkcji porcelany, ceramiki i ceramiki.
Ryzyko
Wdychanie pyłu Znco3 Może powodować rządzące, kaszel, klatkę piersiową, gorączkę i dyskomfort. Jego spożycie powoduje nudności i wymioty.
Wpływ na środowisko
Głównym ryzykiem jest jego wpływ na środowisko, dlatego należy go uniknąć, aby zostać rozproszonym w tym. To bardzo toksyczne wobec życia wodnego z konsekwencjami, które trwają w żywych organizmach.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Węglan cynku. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Sharma, v. i in. (2018). Synteza nanoneedłów węglanowych cynku, do potencjalnego opóźnienia płomienia dla tekstyliów bawełnianych. Celuloza 25, 6191-6205 (2018). Link odzyskał.Skoczek.com.
- Guan i. i in. (2020). Koloidalny ZNCO3 jako potężny depresyjczyk arsenopirytu w słabo alkalicznej pulonie i mechanizmie interakcji. Minerals 2020, 10, 315. MDPI odzyskało.com.
- Choroby skóry, oka, spojówki i uchu zewnętrznego. (2017). W medycynie weterynaryjnej (Eleventh Edition). Odzyskane z naukowym.com.
- Hannig, m. i Hannig, C. (2013). Nanobiomateriały w stomatologii profilaktycznej. W nanobiomateriałach w stomatologii klinicznej. Rozdział 8. Odzyskane z naukowym.com.
- Tugrul, n. i in. (2015). Synteza hydrofobowych nanostruktur cynku Borek z węglanu cynku i charakterystyka produktu. RES Chem Intermediate (2015) 41: 4395-4403. Link odzyskał.Skoczek.com.
- Luna, m.D.G., i in. (2020). Odzyskiwanie granulek cynku z syntetycznych ścieków galwanicznych przy użyciu homogenicznego procesu krystalizacji fluidowanego. Int. J. Środowisko. Sci. Technol. 17, 129-142 (2020). Link odzyskał.Skoczek.com.

